题目内容
4.乙烯与乙炔的混合气体完全燃烧时,消耗氧气的体积是混合气体的2.8倍,则原混合气体对氢气的相对密度为( )| A. | 12.6 | B. | 13 | C. | 13.5 | D. | 13.6 |
分析 假设乙烯、乙炔的体积分别为xL、yL,则混合气体消耗氧气为2.8(x+y)L,根据方程式表示出各自消耗氧气的体积,据此列方程计算x、y的比例关系,从而求出混合气体的相对分子量,由此解答.
解答 解:假设乙烯、乙炔的体积分别为xL、yL,则混合气体消耗氧气为2.8(x+y)L,
C2H4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O
xL 3xL
C2H2+2.5O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+H2O
yL 2.5yL
则3xL+2.5yL=2.8(x+y)L
整理得x=1.5y,所以原混合气体对氢气的相对密度为:$\frac{28x+26y}{\frac{x+y}{2}}$=$\frac{27.2}{2}$=13.6,
故选D.
点评 本题考查混合物计算、烃的燃烧的计算,难度不大,注意利用方程式解答.

练习册系列答案
相关题目
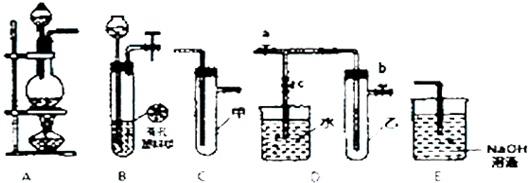
14.下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的气体(暂不考虑尾气吸收).关于这些装置的连接,下列说法正确的是( )

| A. | 加热浓硫酸和乙醇的混合物至170℃制备收集C2H4:连接a→d→f | |
| B. | 制备收集NO2:连接a→c→f | |
| C. | 制备收集Cl2:连接a→d→e | |
| D. | 制备收集NH3:连接b→d→e |
19.苯环结构中不存在碳碳单、双键交替出现的结构,下列可以作为证据的事实是( )
①苯不能使高锰酸钾酸性溶液褪色 ②苯不能使溴水因发生化学反应而褪色
③苯在加热和有催化剂存在的条件下能生成环己烷 ④苯中碳碳键长完全相等
⑤邻二氯苯只有一种 ⑥间二氯苯只有一种.
①苯不能使高锰酸钾酸性溶液褪色 ②苯不能使溴水因发生化学反应而褪色
③苯在加热和有催化剂存在的条件下能生成环己烷 ④苯中碳碳键长完全相等
⑤邻二氯苯只有一种 ⑥间二氯苯只有一种.
| A. | ①②④⑤ | B. | ①②③④⑥ | C. | ①⑤ | D. | ①② |
6.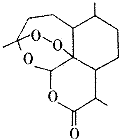 2015年10月5日,中国科学家屠哟坳首次获诺贝尔生理学或医学奖,以表彰她创制新型抗疟药-青蒿素和双氢青蒿素,其中青蒿素的结构简式如图所示,则青蒿素分子中碳、氧原子的个数比为( )
2015年10月5日,中国科学家屠哟坳首次获诺贝尔生理学或医学奖,以表彰她创制新型抗疟药-青蒿素和双氢青蒿素,其中青蒿素的结构简式如图所示,则青蒿素分子中碳、氧原子的个数比为( )
 2015年10月5日,中国科学家屠哟坳首次获诺贝尔生理学或医学奖,以表彰她创制新型抗疟药-青蒿素和双氢青蒿素,其中青蒿素的结构简式如图所示,则青蒿素分子中碳、氧原子的个数比为( )
2015年10月5日,中国科学家屠哟坳首次获诺贝尔生理学或医学奖,以表彰她创制新型抗疟药-青蒿素和双氢青蒿素,其中青蒿素的结构简式如图所示,则青蒿素分子中碳、氧原子的个数比为( )| A. | 2:1 | B. | 3:1 | C. | 12:5 | D. | 16:5 |
3.已知铍元素是第二周期第ⅡA族元素,化学性质与铝相似,下列叙述正确的是( )
| A. | 常温下,单质铍能与水反应放出H2 | |
| B. | Be(OH)2易溶于水 | |
| C. | Be(OH)2溶于盐酸,也可能溶于NaOH溶液 | |
| D. | BeCl2中各原子中的最外层电子层都满足8电子结构 |