题目内容
9.瑞典ASES公司设计的用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )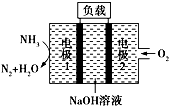
| A. | 电池工作时,电极2上发生氧化反应 | |
| B. | 电池工作一段时间后停止,溶液pH值比开始时明显增大 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
分析 该燃料电池中,通入氨气的电极是负极、通入氧化剂氧气的电极是正极,则1是负极、2是正极,
A.负极上失电子发生氧化反应、正极上得电子发生还原反应;
B.电池反应式为4NH3+3O2═2N2+6H2O,反应中有水生成,导致溶液体积偏大,溶质的物质的量不变;
C.负极上氨气失电子和氢氧根离子反应生成氮气和水;
D.电解精炼粗铜时,阳极上金属失电子发生氧化反应,阴极上铜离子得电子生成Cu.
解答 解:该燃料电池中,通入氨气的电极是负极、通入氧化剂氧气的电极是正极,则1是负极、2是正极,
A.负极上失电子发生氧化反应、正极上得电子发生还原反应,2是正极,该电极上得电子发生还原反应,故A错误;
B.电池反应式为4NH3+3O2═2N2+6H2O,反应中有水生成,导致溶液体积偏大,溶质的物质的量不变,导致溶液中c(NaOH)降低,则溶液的pH减小,故B错误;
C.负极上氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3+6OH--6e-═N2↑+6H2O,故C正确;
D.电解精炼粗铜时,阳极上金属失电子发生氧化反应,阴极上铜离子得电子生成Cu,根据转移电子守恒计算生成Cu的质量=$\frac{0.2mol×3}{2}×64g/mol$=19.2g,故D错误;
故选C.
点评 本题考查原电池和电解池原理,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,结合电解质溶液酸碱性书写,易错选项是D,题目难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案
相关题目
17.下列化学用语的表述正确的是( )
| A. | Cl-的结构示意图: | B. | CCl4的电子式: | ||
| C. | 丙烯的结构简式:CH3CH2CH2 | D. | 次氯酸的结构式:H-Cl-O |
14.氨气在纯氧中燃烧(如图所示),生成化学性质稳定的气体X和水.下列说法正确的是( )
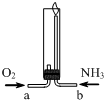

| A. | 气体X的分子式为NO | |
| B. | N2、N4为元素N的两种同素异形体 | |
| C. | 该反应条件下,氨气的还原性小于水 | |
| D. | 两种气体通入的先后顺序是NH3、O2 |
1.化学与生产、生活、社会密切相关,下列说法错误的是( )
| A. | 绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 | |
| B. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| C. | 臭氧、高锰酸钾溶液、次氯酸钠溶液、乙醇溶液均可用于消毒杀菌,且原理相同 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生相关 |
18.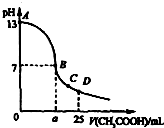 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L-1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L-1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,不正确的是( )
 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L-1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L-1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,不正确的是( )| A. | C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | D点时c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| C. | 曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | B点的横坐标a=12.5ml |
19.下列关于有机反应的说法正确的是( )
| A. | 己烷与溴的取代反应必须在光照条件下才能进行 | |
| B. | 氯乙烯聚合成聚氯乙烯塑料的本质是加成反应 | |
| C. | 苯与溴的取代反应的催化剂可以是FeBr3,也可以是Fe粉 | |
| D. | 溴乙烷的制取采取加成反应或取代反应的方法都一样 |
 某化学创新实验小组设计了如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.
某化学创新实验小组设计了如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃. ;
;