题目内容
3.可逆反应:2NO2$\stackrel{△}{?}$2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )①单位时间内生成n molO2的同时生成2n molNO2;
②单位时间内生成n molO2 的同时生成2n mol NO;
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体中$\frac{n(N{O}_{2})}{n(NO)}$不变;
⑤混合气体的颜色不再改变的状态;
⑥混合气体的密度不再改变的状态;
⑦混合气体的平均相对分子质量不再改变的状态.
| A. | ①⑤⑥ | B. | ①④⑤⑦ | C. | ①⑤⑥⑦ | D. | ①③⑤⑥⑦ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①单位时间内生成n molO2等效于消耗2n molNO2同时生成2n molNO2,正逆反应速率相等,达平衡状态,故正确;
②单位时间内生成n molO2 的同时生成2n mol NO,都体现的正反应方向,故错误;
③只要反应发生,就有NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态,故错误;
④混合气体中$\frac{n(N{O}_{2})}{n(NO)}$不变,说明各物质的量不变,反应达平衡状态,故正确;
⑤混合气体的颜色不再改变的状态,说明二氧化氮的浓度不变,反应达平衡状态,故正确;
⑥混合气体的密度一直不再随时间的改变而改变的状态,故错误;
⑦混合气体的平均相对分子质量不再改变的状态,说明各物质的量不变,反应达平衡状态,故正确;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
13.在反应H2+Cl2=2HCl中,已知H-H键能为436kJ/mol,Cl-Cl键能为247kJ/mol,H-Cl键能为431kJ/mol,判断该反应是( )
| A. | 每生成2molHCl放出179kJ热量 | B. | 每生成1molHCl放出179kJ热量 | ||
| C. | 每生成2molHCl吸收179kJ热量 | D. | 每生成1molHCl吸收179kJ热量 |
14.某同学写出的下列烷烃的名称中,不正确的是( )
| A. | 2,3-二甲基丁烷 | B. | 2,5-二甲基-4-乙基己烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
8.把下列四种溶液分别加入四个盛有10mL 2mol•L-1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓慢反应,其中反应最快的是( )
| A. | 10℃15mL、3mol•L-1的X溶液 | B. | 10℃30mL、1mol•L-1 的X溶液 | ||
| C. | 10℃30mL、2 mol•L-1 的X溶液 | D. | 10℃10mL、4mol•L-1 的X溶液 |
15.下列情况下平衡一定发生移动的是( )
| A. | 混合物中各组分的浓度改变 | B. | 正、逆反应速率改变 | ||
| C. | 平衡体系的温度改变 | D. | 混合气体的压强改变 |
12.可逆反应H2(g)+I2(g)?2HI(g)达到限度时的标志是( )
| A. | 混合气体密度恒定不变 | B. | 消耗n mol H2同时生成2n mol HI | ||
| C. | H2、I2、HI的浓度相等 | D. | 混合气体的颜色不再改变 |
13.在某温度时,测得纯水中的c(H+)=2.0×10-7mol•L-1,下列说法正确的是( )
| A. | c(OH-)=2.0×10-7mol•L-1 | B. | Kw=1×10-14 | ||
| C. | c(OH-)=1.0×10-14/2.0×10-7mol•L-1 | D. | 温度为25℃ |
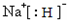 ,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.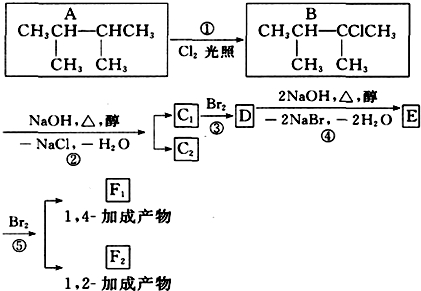
 .
. ;F 1的结构简式是
;F 1的结构简式是 .
.