题目内容
10.下列反应,最终无沉淀产生的是( )| A. | SO2通入盐酸酸化的硝酸钡溶液 | B. | 在AlCl3溶液中滴入过量的氨水 | ||
| C. | 在空气中长期存放的漂白粉溶液 | D. | 将少量NaAlO2投入盐酸中 |
分析 A.酸性条件下硝酸根离子具有强氧化性,能够将二氧化硫氧化成硫酸,钡离子与硫酸反应生成硫酸钡沉淀;
B.铝离子与氨水反应生成氢氧化铝沉淀;
C.漂白粉的有效成分为次氯酸钙,次氯酸钙溶液与空气中二氧化碳反应生成碳酸钙;
D.盐酸过量,偏铝酸钠与盐酸反应生成氯化铝、氯化钠和水.
解答 解:A.SO2通入盐酸酸化的硝酸钡溶液,二氧化硫被氧化成硫酸,硫酸与钡离子反应生成硫酸钡沉淀,故A错误;
B.在AlCl3溶液中滴入过量的氨水,二者反应生成氢氧化铝沉淀,故B错误;
C.在空气中长期存放的漂白粉溶液,次氯酸钙与空气中二氧化碳反应生成碳酸钙沉淀,故C错误;
D.将少量NaAlO2投入盐酸中,由于盐酸过量,反应生成氯化铝、氯化钠和水,最终不会生成沉淀,故D正确;
故选D.
点评 本题考查了常见元素及其化合物性质的综合应用,题目难度中等,明确常见元素及其化合物性质为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.80mL稀硫酸与足量氯化钡溶液反应,得到46.6g沉淀,此稀硫酸的浓度是( )
| A. | 5mol/L | B. | 1.25mol/L | C. | 2.5mol/L | D. | 3mol/L |
1.下列两种气体的分子数一定相等的是( )
| A. | 质量相等、密度不同的N2和C2H4 | B. | 体积相等的CO和N2 | ||
| C. | 等温、等体积的O2和N2 | D. | 等压、等体积的N2和CH4 |
5.下列说法正确的是( )
| A. | 石油化工水平的标志是乙烯产量 | |
| B. | 天然气的主要成分是丙烷 | |
| C. | 糖尿病患者不可以用新制备的氢氧化铜检验 | |
| D. | 乙醇在铜丝的催化氧化下可生成无色无刺激性的乙醛 |
15.已知硅与Na0H溶液反应的化学方程式为:Si+2Na0H+H20=Na2SiO3+2H2↑.今取相同质量的、组成完全相同的某种由硅、铝、铁组成的合金粉末两份,一份投入到足量的稀硫酸中,另一份投入到足量的浓NaOH溶液中,结果在相同条件下收集到相同体积的气体.则原合金中铁与硅的质量比是( )
| A. | 1:1 | B. | 2:1 | C. | 4:1 | D. | 无法确定 |
4.下列物质既能发生消去反应,又能发生水解反应的是( )
| A. | 氯仿 | B. | 溴苯 | C. | 2-氯-2-甲基丙烷 | D. | 乙醇 |
1.先取甲、乙、丙、丁四种金属粉末,分别投入相同浓度的稀盐酸中,只有甲、乙能产生气体,乙反应更剧烈;再取一小块丁投入丙的硝酸盐溶液中,丁的表面有丙析出.则甲、乙、丙、丁四种金属的活动性顺序为( )
| A. | 甲>乙>丙>丁 | B. | 乙>甲>丙>丁 | C. | 丁>丙>乙>甲 | D. | 乙>甲>丁>丙 |

 ;
; .
.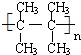 在催化剂作用下,与H2加成后的产物名称为2,3-二甲基丁烷.
在催化剂作用下,与H2加成后的产物名称为2,3-二甲基丁烷.