题目内容
4.按要求写出下列化学方程式.①甲苯→TNT
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O
+3H2O②乙醛与银氨溶液反应的离子方程式CH3CHO+2[Ag(NH3)2]OH$\stackrel{水浴加热}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O
③2-溴丙烷→丙烯CH3CHBrCH3+NaOH $→_{△}^{乙醇}$CH3-CH=CH2↑+NaBr+H2O
④乙烯→乙醇CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH.
⑤苯酚钠溶液中通入二氧化碳气体的离子方程式
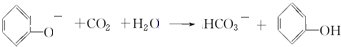 .
.
分析 ①在浓硫酸作催化剂、加热条件下,甲苯和硝酸发生取代反应生成TNT;
②乙醛与银氨溶液反应生成醋酸铵、银单质、氨气和水;
③2-溴丙烷在氢氧化钠的醇溶液中发生消去反应生成丙烯、溴化钠和水;
④一定条件下,乙烯和水发生加成反应生成乙醇;
⑤苯酚钠与二氧化碳反应生成苯酚和碳酸氢钠.
解答 解:①浓硫酸作催化剂、加热条件下,甲苯和硝酸发生取代反应生成TNT,反应为 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O,
+3H2O,
故答案为: +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O;
+3H2O;
②乙醛与银氨溶液发生银镜反应,反应的化学方程式为:CH3CHO+2[Ag(NH3)2]OH$\stackrel{水浴加热}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O,故答案为:CH3CHO+2[Ag(NH3)2]OH$\stackrel{水浴加热}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O;
③2-溴丙烷在氢氧化钠的醇溶液中发生消去反应生成丙烯、溴化钠和水,反应的化学方程式为:CH3CHBrCH3+NaOH $→_{△}^{乙醇}$CH3-CH=CH2↑+NaBr+H2O,
故答案为:CH3CHBrCH3+NaOH $→_{△}^{乙醇}$CH3-CH=CH2↑+NaBr+H2O;
④一定条件下,乙烯和水发生加成反应生成乙醇,反应方程式为CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;
⑤苯酚钠与二氧化碳反应生成苯酚和碳酸氢钠,反应的化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,离子反应方程式为: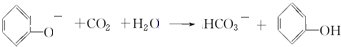 ,故答案为:
,故答案为: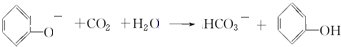 .
.
点评 本题考查化学方程式有关书写,为高频考点,明确物质官能团及其性质关系、反应条件及产物是解本题关键,注意苯酚钠和二氧化碳、水反应生成碳酸氢钠而不是碳酸钠,为易错点.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 油脂 | B. | 淀粉 | C. | 蛋白质 | D. | 纤维素 |
| A. | 第一周期第ⅠA族 | B. | 第二周期第VⅡA族 | C. | 第三周期第VⅡA族 | D. | 第三周期第ⅥA族 |
①乙烯的最简式C2H4
②乙醇的结构简式C2H6O
③四氯化碳的电子式

④乙炔的结构简式CHCH
⑤乙烷的结构式CH3CH3
⑥乙醛的结构简式CH3COH.
| A. | 全对 | B. | 全错 | C. | ③⑤ | D. | ②③④ |
| A. | 0个 | B. | 2个 | C. | 3个 | D. | 4个 |