题目内容
 元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:(1)阴影部分元素N在元素周期表中的位置为第
H3AsO4
(2)根据NaH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第
(3)元素甲是第三周期金属元素中原子半径最小的元素,该元素的离子与过量氨水反应的离子方程式为:
(4)周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用.已知R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为
A.硫 B.砷 C.硒 D.硅
(5)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子的形成过程:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)N元素处于周期表中第二周期ⅤA族;同主族自上而下非金属性减弱,非金属性越强,最高价氧化物对应水化物的酸性越强;
(2)根据最高正价与最低负价的绝对值相等,把氢元素放在周期表中的ⅣA族;
(3)元素甲是第三周期金属元素中原子半径最小的元素,则甲为Al,铝离子与过量氨水反应生成氢氧化铝沉淀与铵根离子;
(4)R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,最外层电子数为6,处于第四周期ⅥA族;
(5)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,则COS的电子式为 .
.
(2)根据最高正价与最低负价的绝对值相等,把氢元素放在周期表中的ⅣA族;
(3)元素甲是第三周期金属元素中原子半径最小的元素,则甲为Al,铝离子与过量氨水反应生成氢氧化铝沉淀与铵根离子;
(4)R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,最外层电子数为6,处于第四周期ⅥA族;
(5)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,则COS的电子式为
 .
.解答:
解:(1)N元素原子有2个电子层,最外层电子数为5,位于元素周期表中第二周期第ⅤA族;同主族从上到下非金属性减弱,则最高价含氧酸的酸性越弱,则酸性H3AsO4<H3PO4,
故答案为:二;VA族;<;
(2)根据最高正价与最低负价的绝对值相等,把氢元素放在周期表中的ⅣA族,故答案为:ⅣA;
(3)元素甲是第三周期金属元素中原子半径最小的元素,则甲为Al,铝离子与过量氨水反应生成氢氧化铝沉淀与铵根离子,反应离子方程式为:Al3+﹢3NH3?H2O=Al(OH)3↓+3NH4﹢,
故答案为:Al3+﹢3NH3?H2O=Al(OH)3↓+3NH4+;
(4)R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,最外层电子数为6,处于第四周期ⅥA族,为Se元素,故答案为:C;
(5)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,则C与O、C与S均形成两对共有电子对,COS的电子式为 ,用电子式表示羰基硫分子的形成过程为
,用电子式表示羰基硫分子的形成过程为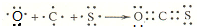 ,
,
故答案为: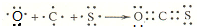 .
.
故答案为:二;VA族;<;
(2)根据最高正价与最低负价的绝对值相等,把氢元素放在周期表中的ⅣA族,故答案为:ⅣA;
(3)元素甲是第三周期金属元素中原子半径最小的元素,则甲为Al,铝离子与过量氨水反应生成氢氧化铝沉淀与铵根离子,反应离子方程式为:Al3+﹢3NH3?H2O=Al(OH)3↓+3NH4﹢,
故答案为:Al3+﹢3NH3?H2O=Al(OH)3↓+3NH4+;
(4)R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,最外层电子数为6,处于第四周期ⅥA族,为Se元素,故答案为:C;
(5)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,则C与O、C与S均形成两对共有电子对,COS的电子式为
 ,用电子式表示羰基硫分子的形成过程为
,用电子式表示羰基硫分子的形成过程为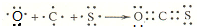 ,
,故答案为:
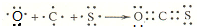 .
.
点评:本题考查位置结构性质的关系及应用,难度不大,注意掌握电子式表示物质的形成或化学键的形成过程.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A、NA个氧分子和NA个氢分子的质量比等于8:1 |
| B、11.2L H2中含有的原子数为NA个 |
| C、54g H2O中含有分子数为3NA个 |
| D、1mol/L Na2SO4溶液中离子数为3NA个 |
镁锰干电池的电化学反应式为:Mg+2MnO2+H2O═Mg(OH)2+Mn2O3.下列说法不正确的是( )
| A、镁为负极,发生氧化反应 |
| B、可以选择碱性溶液作为电解质 |
| C、反应后正极和负极附近溶液的pH均升高 |
| D、正极的电极反应为:2MnO2+H2O+2e-═Mn2O3+2OH- |
 硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.