题目内容
14.高中化学学习过程中的物质颜色是需要注意的.下列关于颜色的描述正确的个数是( )①钾元素的焰色反应透过蓝色的钴玻璃观察呈紫色
②KI溶液中加入淀粉溶液会变成蓝色
③溴水中加入CCl4振荡静置后,CCl4层无色.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①K元素的焰色反应必须透过蓝色的钴玻璃观察;
②碘单质遇淀粉试液变蓝色,碘离子遇淀粉试液不变色;
③四氯化碳能萃取溴水中的溴.
解答 解:①K元素的焰色反应透过蓝色的钴玻璃观察滤掉黄光的干扰,故①正确;
②因单质碘才能使淀粉溶液变成蓝色,碘离子遇淀粉试液不变色,所以KI溶液中I-不能使淀粉溶液变成蓝色,故②错误;
③因溴水中加入CCl4振荡静置后,溴从水中转移到CCl4中,CCl4因溶解溴呈橙红色,故③错误;
故选A.
点评 本题考查元素化合物性质、焰色反应等知识点,明确物质性质、萃取原理、焰色反应原理等是解本题关键,知道碘单质性质的特殊性,知道萃取剂的选取方法,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
4.在指定环境中,下列各组离子一定可以大量共存的是( )
| A. | 使pH试纸呈红色的溶液中:I-、NO3-、SO42-、Na+ | |
| B. | 水电离出的c(H+)=1×10-13mol/L的溶液中:CO32-、K+、ClO-、SO32- | |
| C. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液中:NH4+、Ca2+、C1-、K+ | |
| D. | 加入铝粉能产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42- |
2.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CF4 | ||
| C. | NH3>H2O>N2>CO | D. | 生铁>钠>纯铁 |
9.将7mLNO2和NO的混和气体通过足量的饱和NaHCO3溶液和浓硫酸后,再通过足量Na2O2,后气体体积变为3.5mL.则原混和气体中NO2和NO的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | ≧3:1的任意比 |
6.有关晶体的下列说法中,正确的是( )
| A. | 分子晶体中分子间作用力越大,分子越稳定 | |
| B. | 二氧化硅的熔点、硬度均比二氧化碳高 | |
| C. | 冰融化时水分子时,仅共价键发生断裂,分子本身没有变化 | |
| D. | 氯化钠熔化时离子键被破坏,故属于化学变化 |
3.与27.0克H2O含有相同中子数的D2O质量为( )
| A. | 13.2g | B. | 20.1g | C. | 22.0g | D. | 24.0g |
4.某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱.
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;
②溴单质易挥发,碘单质易升华;
③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示.
实验方案:该小组设计如图所示装置实验(夹持仪器已略去,装置气密性完好)
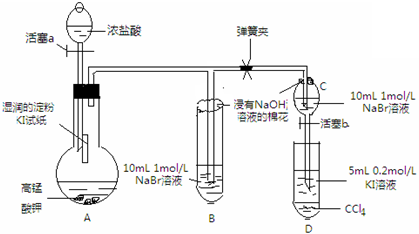
实验过程:
Ⅰ先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ…
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是A中湿润的淀粉碘化钾试纸变蓝,写出该反应的化学方程式Cl2+2KI═I2+2KCl;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘,写出该反应的离子方程式2I-+Br 2=2Br-+I2;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为Cl2>Br2>I2;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应.
实验目的:探究Cl2、Br2、I2的氧化性强弱.
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;
②溴单质易挥发,碘单质易升华;
③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示.
| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |

实验过程:
Ⅰ先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ…
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是A中湿润的淀粉碘化钾试纸变蓝,写出该反应的化学方程式Cl2+2KI═I2+2KCl;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘,写出该反应的离子方程式2I-+Br 2=2Br-+I2;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为Cl2>Br2>I2;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应.
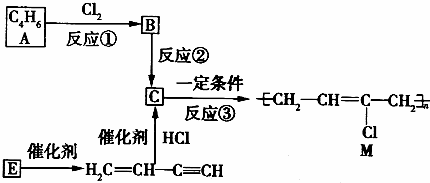
 .
.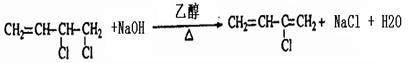 .
. 、
、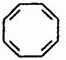 .鉴别这两个环状化合物的试剂为溴水或酸性高锰酸钾溶液.
.鉴别这两个环状化合物的试剂为溴水或酸性高锰酸钾溶液.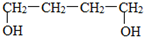 ),其反应步骤为:(第一、三步用化学方程式表示)
),其反应步骤为:(第一、三步用化学方程式表示)