题目内容
18.常温下,下列溶液中各组离子一定能大量共存的是( )| A. | 加入铝粉有氢气生成的溶液中:Mg2+,Cl-,NO3-,K+ | |
| B. | 常温下,c(H+)=0.1 mol/L的溶液中:Na+,AlO2-、S2-、SO32- | |
| C. | 含有0.1 mol/LHCO3-的溶液:Na+,Fe3+,NO3-,SCN- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+,K+,CO32-,NO3- |
分析 A.加入铝粉有氢气生成的溶液,为非氧化性酸或强碱溶液;
B.常温下,c(H+)=0.1 mol/L的溶液,显酸性;
C.离子之间结合生成络离子,离子之间发生相互促进水解反应;
D.$\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液,显碱性.
解答 解:A.加入铝粉有氢气生成的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在Mg2+,酸溶液中Al、NO3-发生氧化还原反应不生成氢气,故A不选;
B.常温下,c(H+)=0.1 mol/L的溶液,显酸性,不能大量存在AlO2-、S2-、SO32-,且S2-、SO32-发生氧化还原反应,故B不选;
C.Fe3+、SCN-结合生成络离子,Fe3+、HCO3-发生相互促进水解反应,不能共存,故C不选;
D.$\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液,显碱性,该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
6.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O2 ? CO2 | ||
| C. | CaCl2 NaOH H2O | D. | CH4 H2O CS2 |
13.下列叙述正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子数总是从 1~8 重复出现 | |
| B. | 随着原子序数的递增,元素的最高正化合价从+1到+7,负价从-7到-1重复出现 | |
| C. | 第3周期中,随着核电荷数的递增,元素的离子半径依次减小 | |
| D. | 随核电荷数递增,ⅦA族元素单质熔、沸点升高,碱金属元素单质熔、沸点降低 |
3.关于反应N2+3H2$?_{△}^{催化剂}$2NH3的说法错误的是( )
| A. | 外界条件可以改变平衡状态 | B. | 达到平衡时正、逆反应速率相等 | ||
| C. | 平衡时各组分的含量也在不断变化 | D. | 该反应所建立的平衡是动态平衡 |
10.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 1mol冰中有2mol氢键 | |
| C. | 17.6g丙烷中所含的极性共价键为3.2NA个 | |
| D. | 1molH3O+含有11mol电子 |
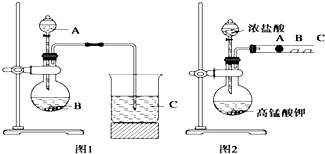 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答: