题目内容
6.下列各组物质中化学键的类型相同的是( )| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O2 ? CO2 | ||
| C. | CaCl2 NaOH H2O | D. | CH4 H2O CS2 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
解答 解:A.HCl中只含共价键,MgCl2只含离子键,NH4Cl含离子键和共价键,故A不选;
B.H2O、CO2中只含共价键,Na2O2含离子键、共价键,故B不选;
C.CaCl2含离子键,NaOH含离子键、共价键,H2O中只含共价键,故C不选;
D.均在含共价键,故D选;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列实验操作可以达到实验目的是( )
| 实 验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体直接通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 除去溴水中的少量溴化钠 | 加入乙醇,震荡,静置,分液,取出上层液体 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
14.低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为2NH3(g)+NO(g)+NO2(g)$→_{催化剂}^{150℃}$2N2(g)+3H2O(g)△H<0,在恒容的密闭容器中,下列有关说法不正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率增大 | |
| C. | 单位时间内消耗NO和N2的物质的量比为1:1时,反应达到平衡 | |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率不变 |
1.下列有关烷烃的命名错误的是( )
| A. |  2甲基丁烷 2甲基丁烷 | B. |  2,2,4三甲基戊烷 2,2,4三甲基戊烷 | ||
| C. | (CH3CH2)2CHCH3 3甲基戊烷 | D. |  异戊烷 异戊烷 |
18.常温下,下列溶液中各组离子一定能大量共存的是( )
| A. | 加入铝粉有氢气生成的溶液中:Mg2+,Cl-,NO3-,K+ | |
| B. | 常温下,c(H+)=0.1 mol/L的溶液中:Na+,AlO2-、S2-、SO32- | |
| C. | 含有0.1 mol/LHCO3-的溶液:Na+,Fe3+,NO3-,SCN- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+,K+,CO32-,NO3- |
16.下列说法错误的是( )
| A. | 元素的最高正价数一定等于其原子核外最外层电子数 | |
| B. | 原子序数为79的元素在第六周期第IB族 | |
| C. | 碱金属单质的熔、沸点从上到下递减 | |
| D. | 同周期从左到右,元素的金属性递减,非金属性递增 |
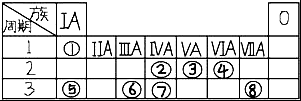 表为元素周期表的一部分,请参照元素①⑧在表中的位置,回答下列问题:
表为元素周期表的一部分,请参照元素①⑧在表中的位置,回答下列问题: