题目内容
20.元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分.| 族 周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | He |
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K | L |
(2)下列有关元素性质的递变规律正确的是C
A.氢氧化物的碱性E<F<G B.获得电子的能力I>J>K
C.气态氢化物的稳定性D>K D.原子半径H<I<J<K
(3)对于第三周期的非金属元素(除Ar外),从左到右,原子半径逐渐减小,单质的氧化性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强.
分析 由元素在周期表的位置可知,A~L为H、Li、O、F、Na、Mg、Al、Si、P、S、Cl、Ar,
(1)G为铝,非金属性越强,越易得到电子;
(2)A.金属性越强,对应氢氧化物的碱性越强;
B.非金属性越强,越易得到电子;
C.非金属性越强,氢化物越稳定;
D.同周期从左向右原子半径减小;
(3)同周期从左向右原子半径减小、非金属性增强.
解答 解:由元素在周期表的位置可知,A~L为H、Li、O、F、Na、Mg、Al、Si、P、S、Cl、Ar,
(1)表中G的元素符号是Al;最易获得电子的元素是氟,故答案为氟:Al;氟;
(2)A.金属性越强,对应氢氧化物的碱性越强,则碱性为E>F>G,故A错误;
B.非金属性越强,越易得到电子,则获得电子的能力I<J<K,故B错误;
C.非金属性越强,氢化物越稳定,则气态氢化物的稳定性D>K,故C正确;
D.同周期从左向右原子半径减小,则原子半径H>I>J>K,故D错误;
故答案为:C;
(3)同周期从左向右原子半径减小、非金属性增强,则对于第三周期的非金属元素(除Ar外),从左到右,原子半径逐渐减小,单质的氧化性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强,
故答案为:减小;增强;增强.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
11.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 如图随着CO2的通入,$\frac{{c(OH}^{-})}{{c(NH}_{3}•{H}_{2}O)}$不断减小 | |
| C. | 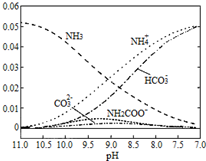 在如图所示不同pH的溶液中一定存在关系:c(NH4+)≥2c(CO32-)+c(HCO3-)+c(NH2COO-) | |
| D. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 |
9.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 46g乙醇中存在的共价键总数为8NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cl-个数为NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移的电子总数为1.5NA |
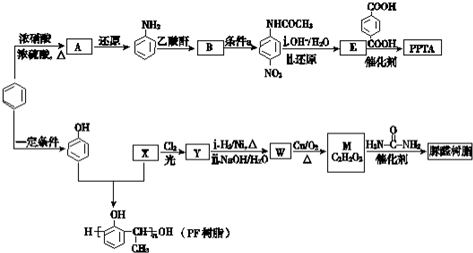
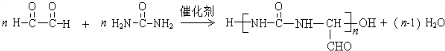
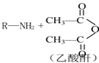 →R-NHCOCH2+CH2COOH(R为烃基)
→R-NHCOCH2+CH2COOH(R为烃基)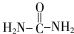 (尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.
(尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.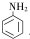 →B 的反应类型是取代反应.
→B 的反应类型是取代反应. .
. .
.