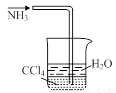
题目内容
9.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )| A. | 46g乙醇中存在的共价键总数为8NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cl-个数为NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移的电子总数为1.5NA |
分析 A.求出乙醇的物质的量,然后根据乙醇中含8条共价键来分析;
B.溶液体积未知;
C.求出混合物的物质的量,然后根据1mol氢气和1molCO燃烧时均消耗0.5mol氧气来分析;
D.该反应中,4mol氯气反应生成6molNaCl,转移了6mol电子,据此计算出消耗1mol氯气转移的电子数.
解答 解:A.46g乙醇的物质的量为1mol,而乙醇中含8条共价键,故含8NA条,故A正确;
B.溶液体积未知,无法计算微粒个数,故B错误;
C.标况下8.96L混合物的物质的量为0.4mol,而1mol氢气和1molCO燃烧时均消耗0.5mol氧气,故0.4mol混合气体燃烧消耗0.2mol氧气,与两者的比例无关,故C正确;
D.反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O转移6mol电子,消耗4mol氯气,故当消耗1mol氯气时转移1.5mol电子即1.5NA个,故D正确;
故选:B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,明确好以物质的量为中心的各化学量与阿伏加德罗常数的关系为解答关键,注意乙醇结构特点.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目
20.元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分.
(1)表中G的元素符号是Al;最易获得电子的元素是氟.(填元素名称)
(2)下列有关元素性质的递变规律正确的是C
A.氢氧化物的碱性E<F<G B.获得电子的能力I>J>K
C.气态氢化物的稳定性D>K D.原子半径H<I<J<K
(3)对于第三周期的非金属元素(除Ar外),从左到右,原子半径逐渐减小,单质的氧化性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | He |
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K | L |
(2)下列有关元素性质的递变规律正确的是C
A.氢氧化物的碱性E<F<G B.获得电子的能力I>J>K
C.气态氢化物的稳定性D>K D.原子半径H<I<J<K
(3)对于第三周期的非金属元素(除Ar外),从左到右,原子半径逐渐减小,单质的氧化性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强.
14.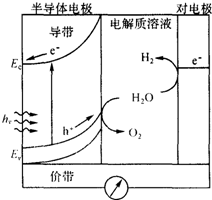 太阳能发电和阳光分解水制氢气,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面.如图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带是未充填电子的能级最低的能带,半导体价带是已充填价电子的能级最高的能带,图中的e-为电子、h+为空穴.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极.下列说法不正确的是( )
太阳能发电和阳光分解水制氢气,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面.如图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带是未充填电子的能级最低的能带,半导体价带是已充填价电子的能级最高的能带,图中的e-为电子、h+为空穴.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极.下列说法不正确的是( )
 太阳能发电和阳光分解水制氢气,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面.如图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带是未充填电子的能级最低的能带,半导体价带是已充填价电子的能级最高的能带,图中的e-为电子、h+为空穴.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极.下列说法不正确的是( )
太阳能发电和阳光分解水制氢气,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面.如图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带是未充填电子的能级最低的能带,半导体价带是已充填价电子的能级最高的能带,图中的e-为电子、h+为空穴.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极.下列说法不正确的是( )| A. | 对电极表面发生的电极反应式为:4H++4e-→2H2 | |
| B. | 电池的总反应式为:2H2O$\stackrel{hv}{→}$O2+2H2↑ | |
| C. | 整个过程中实现了太阳能向电能化学能等的转化 | |
| D. | 装置中电流的方向是从半导体电极流向对电极 |
1.下列反应的离子方程式正确的是( )
| A. | 向硫酸铝溶液中加入少量的氨水:Al3++3OH-═Al(OH) 3↓ | |
| B. | 向碳酸钠溶液中加入饱和石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 向氢氧化钠溶液中通入过量的氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 向稀硫酸中加入过量铁粉,先后发生两个反应:2Fe+6H+═2Fe3++3H2↑,Fe+2Fe3+═3Fe2+ |
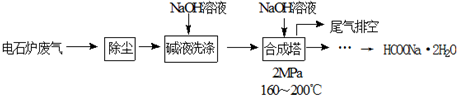
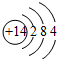 .
.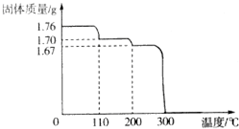 将1.76gHIO3固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:
将1.76gHIO3固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示: