题目内容
15.工业上常用电解法冶炼的金属是Al (选填①Cu ②Fe ③Al ④Ag)分析 活泼金属K、Ca、Na、Mg、Al均利用电解法冶炼,以此来解答.
解答 解:Cu、Fe利用热还原法,Al利用电解熔融氧化铝的方法冶炼得到,Ag利用热分解法,
故答案为:Al.
点评 本题考查金属的冶炼,为高频考点,把握金属的活泼性与冶炼方法的关系为解答的关键,侧重分析与应用能力的考查,注意金属活泼性顺序的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2═C═O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P═O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P═O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
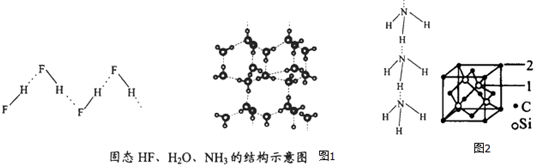
解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}}{4}$apm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}{N}_{A}}$g/cm3.
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2═C═O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P═O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P═O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}}{4}$apm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}{N}_{A}}$g/cm3.
10.下列反应属于氧化还原反应的是( )
| A. | Al(OH)3+NaOH═NaAlO2+2H2O | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Na2O+CO2═Na2CO3 | D. | 2NaHCO3═Na2CO3+CO2↑+H2O |
20.元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分.
(1)表中G的元素符号是Al;最易获得电子的元素是氟.(填元素名称)
(2)下列有关元素性质的递变规律正确的是C
A.氢氧化物的碱性E<F<G B.获得电子的能力I>J>K
C.气态氢化物的稳定性D>K D.原子半径H<I<J<K
(3)对于第三周期的非金属元素(除Ar外),从左到右,原子半径逐渐减小,单质的氧化性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | He |
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K | L |
(2)下列有关元素性质的递变规律正确的是C
A.氢氧化物的碱性E<F<G B.获得电子的能力I>J>K
C.气态氢化物的稳定性D>K D.原子半径H<I<J<K
(3)对于第三周期的非金属元素(除Ar外),从左到右,原子半径逐渐减小,单质的氧化性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强.
1.下列反应的离子方程式正确的是( )
| A. | 向硫酸铝溶液中加入少量的氨水:Al3++3OH-═Al(OH) 3↓ | |
| B. | 向碳酸钠溶液中加入饱和石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 向氢氧化钠溶液中通入过量的氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 向稀硫酸中加入过量铁粉,先后发生两个反应:2Fe+6H+═2Fe3++3H2↑,Fe+2Fe3+═3Fe2+ |
2.己知25℃、101kPa时:4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9kJ•mol-1,4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.1gkJ•mol-1,已知该题中Al与O2的反应中△H=-2834.9kJ•mol-1表示的意义为4molAl(s)与3molO2(g)反应,生成2mol Al2O3(s)放出的能量为2834.9kJ.由此得出的正确结论是( )
| A. | 等质量的O2比O3的能量低,由O2变O3为放热反应 | |
| B. | 等质量的O2比O3的能量高,由O2变O3为吸热反应 | |
| C. | O3比O2稳定,由O2变O3为放热反应 | |
| D. | O2比O3稳定,由O2变O3为吸热反应 |
 .
.