题目内容
18.已知:25℃时,HCOOH的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11.下列说法正确的是( )| A. | 向Na2CO3溶液中加入甲酸无明显现象产生 | |
| B. | 25℃时,向甲酸中加入NaOH溶液,HCOOH的电离程度和K均增大 | |
| C. | 向碳酸中加入NaHCO3固体,c(H+)减小 | |
| D. | 向0.1 mol•L-1甲酸中加入蒸馏水,c(H+)增大 |
分析 A.电离常数越大,酸性越强,酸性强的可以制酸性弱的;
B.电离常数只与温度有关;
C.NaHCO3电离出的碳酸氢根离子抑制碳酸的电离;
D.甲酸的稀溶液中加水稀释,氢离子浓度减小.
解答 解:A.电离常数越大,酸性越强,酸性强的可以制酸性弱的,甲酸的酸性大于碳酸,所以向Na2CO3溶液中加入甲酸会生成二氧化碳气体,故A错误;
B.电离常数只与温度有关,25℃时,向甲酸中加入NaOH溶液,氢离子浓度减小,HCOOH的电离程度增大,K不变,故B错误;
C.NaHCO3电离出的碳酸氢根离子抑制碳酸的电离,溶液中氢离子浓度减小,故C正确;
D.甲酸的稀溶液中加水稀释,促进甲酸的电离,氢离子的物质的量增大,溶液的体积也增大,由于体积增大的快,所以氢离子浓度减小,故D错误.
故选C.
点评 本题考查了弱电解质的电离,明确酸性强弱与其电离程度、电离常数的关系是解本题关键,难度中等,侧重于考查学生的分析能力.

练习册系列答案
相关题目
6.用氢离子浓度相同的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是( )
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | V1≤V2 |
13.对于氨水的电离,下列哪个量只随温度变化而变化( )
| A. | 溶液的pH值 | B. | 电离度 | ||
| C. | 电离平衡常数 | D. | 平衡后,氨水的电离速率 |
3. 欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )
欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )
①将14.2g Na2SO4溶于100mL水中
②将20ml 5.0mol/L Na2SO4溶液用水稀释至100mL
③定容时俯视容量瓶刻度线导致浓度偏大
④摇匀后发现液面低于刻度线需再加水至刻度线.
 欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )
欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )①将14.2g Na2SO4溶于100mL水中
②将20ml 5.0mol/L Na2SO4溶液用水稀释至100mL
③定容时俯视容量瓶刻度线导致浓度偏大
④摇匀后发现液面低于刻度线需再加水至刻度线.
| A. | ②④ | B. | ②③ | C. | ①③ | D. | 以上都不对 |
7.下列说法正确的是( )
| A. | 酸碱中和滴定终点的pH值一定等于7 | |
| B. | 滴定实验中锥形瓶不可用待测液润洗 | |
| C. | 滴定实验中,KMnO4溶液应放在碱式滴定管中 | |
| D. | 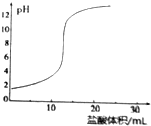 用盐酸滴定NaOH溶液的滴定曲线如图所示 |
8.甲醇是一种重要的化工原料,广泛应用于化工生产,也可直接用作燃料.已知:
CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=-443.64kJ•mol-1;
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1.
下列说法或热化学方程式正确的是( )
CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=-443.64kJ•mol-1;
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1.
下列说法或热化学方程式正确的是( )
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 | |
| D. | 完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ |
