题目内容
8.甲醇是一种重要的化工原料,广泛应用于化工生产,也可直接用作燃料.已知:CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=-443.64kJ•mol-1;
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1.
下列说法或热化学方程式正确的是( )
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 | |
| D. | 完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ |
分析 A.1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热;
B.放热反应中反应物的总能量大于生成物的总能量;
C.根据盖斯定律计算,反应热与计量数成正比,方程式的计量数加倍,则反应热也加倍;
D.根据CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ•mol-1 方程式计算.
解答 解:A.1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1,则CO的燃烧热为283.0 kJ•mol-1,故A错误;
B.放热反应中反应物的总能量大于生成物的总能量,所以2 mol CO和1 mol O2的总能量比2 mol CO2的总能量高,故B错误;
C.已知:①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=-443.64kJ•mol-1 ②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1根据盖斯定律①+②×$\frac{1}{2}$得CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ•mol-1 ,方程式的计量数加倍,则反应热也加倍则2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1,故C正确;
D.CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ•mol-1 ,完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为726.64kJ,故D错误;
故选C.
点评 本题考查了反应热的计算、盖斯定律的应用、热化学方程式的书写等,题目难度不大,注意把握盖斯定律的含义.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案| A. | 向Na2CO3溶液中加入甲酸无明显现象产生 | |
| B. | 25℃时,向甲酸中加入NaOH溶液,HCOOH的电离程度和K均增大 | |
| C. | 向碳酸中加入NaHCO3固体,c(H+)减小 | |
| D. | 向0.1 mol•L-1甲酸中加入蒸馏水,c(H+)增大 |
| A. | 用广泛pH试纸测得Na2CO3溶液的pH为10.5 | |
| B. | 用10mL量筒量取5.20mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用25mL的酸式滴定管量取14.80mL KMnO4溶液 |
①pH试纸检验,溶液的pH>7.
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.
则关于原溶液的判断中不正确的是( )
| A. | 肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
| A. | 苯乙烯  | B. | 苯甲醛  | C. | 苯乙酮  | D. | 苯酚  |
| A. | 1.7×10-3 mol/L | B. | 1.9×10-4mol/L | C. | 1.7×10-4mol/L | D. | 5.7×10-5mol/L. |
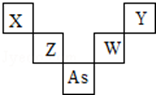 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A. | W的氧化物对应的水化物必是强酸 | |
| B. | X的原子半径比As原子半径小,两者原子序数之差为29 | |
| C. | Z的氧化物可与Y的氢化物水溶液不会发生化学反应 | |
| D. | 图中五种元素均是非金属元素,并且Y的非金属性最强 |