题目内容
15.常温下,将30.0g12.0%的Na2SO4溶液与20.0g24.0%的Na2SO4溶液混合,得到密度为1.20g•cm-3的溶液.试计算:(1)所得溶液中Na2SO4的质量分数.
(2)所得溶液中Na2SO4的物质的量浓度(精确至0.01)
分析 (1)根据m(溶质)=m(溶液)×ω(溶质)计算硫酸钠的总质量,混合后溶液总质量为30.0g+20.0g=50.0g,再结合质量分数定义计算;
(2)根据n=$\frac{m}{M}$计算硫酸钠的物质的量,根据V=$\frac{m}{ρ}$计算溶液体积,根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:(1)混合后溶液中Na2SO4的质量为30.0g×12.0%+20.0g×24.0%=8.40g,混合后溶液总质量为30.0g+20.0g=50.0g,所得溶液中Na2SO4的质量分数为$\frac{8.40g}{50.0g}$×100%=16.8%,
答:所得溶液中Na2SO4的质量分数为16.8%.
(2)Na2SO4的物质的量为$\frac{8.40g}{142g/mol}$,溶液体积为$\frac{50.0g}{1.20×1{0}^{3}g/c{m}^{3}}$,故所得溶液中Na2SO4的物质的量浓度为:$\frac{8.40g}{142g/mol}$÷$\frac{50.0g}{1.20×1{0}^{3}g/c{m}^{3}}$=1.42mol/L,
答:所得溶液中Na2SO4的物质的量浓度为1.42mol/L.
点评 本题考查溶液浓度有关计算,涉及质量分数与物质的量浓度计算,关键是对定义式的理解与灵活应用,注意掌握质量分数与物质的量浓度之间关系,有利于基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.理论上下列反应不能设计成原电池反应的是( )
| A. | 2Fe3++Cu═2Fe2++Cu2+ | B. | Zn+2H+═Zn2++H2↑ | ||
| C. | 2H2+O2═2H2O | D. | H++OH-═H2O |
7.下列关于物质用途的叙述中不正确的是( )
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 氨气可做制冷剂 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 包装食品里常有硅胶、生石灰、还原铁粉等,其作用相同 |


 ;
; ;
; 任意一种(任写一种)
任意一种(任写一种)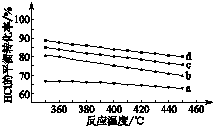 用Cl2生产含氯有机物时会产生HCl.利用反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)可实现氯的循环利用.
用Cl2生产含氯有机物时会产生HCl.利用反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)可实现氯的循环利用.




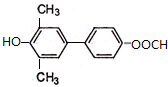 .
.