题目内容
19.某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释的pH变化曲线如图所示,下列判断正确的是( )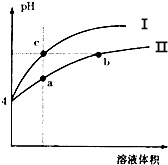
| A. | Ⅰ为氯化铵溶液稀释时pH值变化曲线 | |
| B. | b点比c点溶液的导电能力强 | |
| C. | a点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| D. | b点比a点溶液中的水的电离程度大,但两点的KW相同 |
分析 A.根据盐酸是强酸,完全电离,氯化铵溶液中铵根离子水解溶液显酸性,相同温度下,相同pH值的盐酸和氯化铵溶液,氯化铵浓度大,溶液稀释时,氯化铵水解平衡正向进行,其溶液中离子浓度大于盐酸的离子浓度,故II应为氯化铵稀释时的pH值变化曲线;
B.利用c点、b点溶液中的离子浓度来分析导电性;
C.氯化铵溶液中存在质子守恒,水电离出的氢离子浓度和所有氢氧根离子浓度相同;
D.KW只与温度有关,与溶液的种类以及浓度大小没有关系,b点比a点水解程度大;
解答 解:A、相同温度下,相同pH值的盐酸和氯化铵溶液,氯化铵浓度大,溶液稀释时,氯化铵水解平衡正向进行,其溶液中离子浓度大于盐酸的离子浓度,故II应为氯化铵稀释时的pH值变化曲线,故A错误;
B、溶液导电性取决于离子浓度,bc点的H+浓度相同,氯离子和铵根离子浓度相同,导电性相同,故B错误;
C、a点溶液中氯化铵溶液中存在质子守恒c(H+)=c(NH3•H2O)+c(OH-),故C错误;
D.KW的大小只取决于温度,ab两点相等,但ab两点氯化铵水解程度不同,加水稀释促进水解平衡正向进行,b点水的电离程度大,故D正确;
故选D.
点评 本题考查强弱电解质溶液稀释时的浓度变化,注意加水促进弱电解质电离的特点,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
9.下列有关石油和煤的利用叙述不正确的是( )
| A. | 煤的干馏就是将煤隔绝空气在高温使之分解,得到焦炭、煤焦油等物质的过程 | |
| B. | 煤的液化就是将煤转化成甲醇、乙醇等其液态物质的过程 | |
| C. | 煤的气化就是将煤在高温条件由固态转化为气态的物理变化过程 | |
| D. | 通过催化裂化或裂解,可以获得碳原子数较少的轻质油 |
4.已知某有机物(分子式为C5H10O2)嫩发生水解反应生成甲和乙,乙能与氧气在催化剂Cu的作用下反应生成丙.若甲、丙都不能发生银镜反应,则符合条件的该有机物有(不考虑立体异构)( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
17.奶粉行业的“911事件”将三聚氰胺引入公众视野,工业上可用尿素为原料,在一定条件下合成三聚氰胺:(C3H6N6),对说法正确的是( )
| A. | 摩尔质量为126 | |
| B. | 式量为126 | |
| C. | 每个C3H6N6分子含3个N2分子 | |
| D. | 0.1NA个C3H6N6分子含碳原子数为1.806×1023 |
18.下列表示溶液中发生反应的方程式错误的是( )
| A. | 100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 向HCOOK和KOH的混合溶液中加入KMnO42KMnO4+HCOOK+KOH═2K2MnO4+CO2↑+H2O | |
| D. | 在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
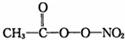 (PAN)等二次污染物.
(PAN)等二次污染物.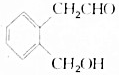 .A可以被新制Cu(OH)2氧化为B;B能在浓硫酸存在和加热时发生分子内的酯化反应生成C,C分子中有一个含氧的六元环.回答下列问题:
.A可以被新制Cu(OH)2氧化为B;B能在浓硫酸存在和加热时发生分子内的酯化反应生成C,C分子中有一个含氧的六元环.回答下列问题: .
.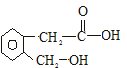 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.