题目内容
8.下列叙述正确的是( )| A. | Mg、Al、Cu在空气中长时间放置,在其表面均生成氧化物 | |
| B. | 把SO2气体分别通入到BaCl2、Ba(NO3)2溶液中均有白色沉淀生成 | |
| C. | 工业上通常用电解钠、镁、铝对应的熔融氯化物制得该三种金属单质 | |
| D. | 将水蒸气通过灼热的铁粉,反应后固体质量增加 |
分析 A.铜表面可以生成铜绿为碱式盐;
B.二氧化硫和氯化钡溶液不反应,通入硝酸钡溶液中析出稀硝酸具有氧化性能氧化二氧化硫为硫酸,结合钡离子生成硫酸钡沉淀;
C.氯化铝为共价化合物熔融不能导电;
D.铁和水蒸气反应生成四氧化三铁和氢气.
解答 解:A.Mg、Al在空气中长时间放置,在其表面均生成氧化物,铜表面可以生成铜绿为碱式碳酸铜为碱式盐,故A错误;
B.二氧化硫和氯化钡溶液不反应,不能生成白色沉淀,通入硝酸钡溶液中析出稀硝酸具有氧化性能氧化二氧化硫为硫酸,结合钡离子生成硫酸钡白色沉淀,故B错误;
C.氯化铝为共价化合物熔融不能导电,工业上是电解熔融氧化铝制备铝,故C错误;
D.铁和水蒸气反应生成四氧化三铁和氢气,3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,反应前后固体质量增加,故D正确;
故选D.
点评 本题考查了物质性质、物质变化现象、金属制备的原理等,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
7.某有机物含C、H、O、N四种元素,其3D模型如图所示.下列有关该有机物的说法正确的是( )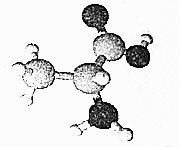

| A. | 常温常压下呈气态 | |
| B. | 分子式为C3H8O2N | |
| C. | 与H2NCH2COOH互为同系物 | |
| D. | 分子中所有C、N原子均处于同一平面 |
16.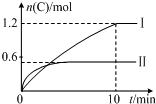 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
| Ⅱ | 800℃ | 1.5mol | 0.5mol | ─ |
| A. | a=-160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10min内平均速率v(B)=0.06mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率增大 |
3.下列有关化学实验的操作中,一般情况下不能相互接触的是( )
| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗下端管口与烧杯内壁 | |
| C. | 分液操作中,分液漏斗下端管口与烧杯内壁 | |
| D. | 用胶头滴管向试管滴加液体时,滴管尖端与试管内壁 |
13.将1molNaHCO3和1mol Na2O2固体混合,在加热的条件下使其充分反应,则最后所得固体为( )
| A. | 1mol Na2CO3和1mol NaOH | B. | 1mol Na2CO3和2mol NaOH | ||
| C. | 2mol Na2CO3和2mol NaOH | D. | 2mol Na2CO3 |
20.某粒子质量数为19,中子数为10,电子数为10,则它的化学符号最合理的是( )
| A. | 199F- | B. | 1910Ne | C. | 2910F | D. | 2919K+ |
17.下列过程所发生的反应属于离子反应的是( )
| A. | H2和O2反应生成水 | B. | 锌片投入稀硫酸中生成H2 | ||
| C. | H2O2分解制取O2 | D. | NH3遇到HCl气体生成白烟 |
18.下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
| 离子组 | 加入试剂 | 离子方程式 | |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | SO42-+2NH4++Ba2++2OH-=BaSO4↓+2NH3•5H2O |
| B | Mg2+、HCO3-、Cl-、 | 过量NaOH溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe3+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
 ,X的电子式是
,X的电子式是 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. .
.