题目内容
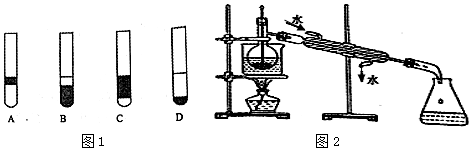
3.下列有关化学实验的操作中,一般情况下不能相互接触的是( )| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗下端管口与烧杯内壁 | |
| C. | 分液操作中,分液漏斗下端管口与烧杯内壁 | |
| D. | 用胶头滴管向试管滴加液体时,滴管尖端与试管内壁 |
分析 A.三层滤纸一侧较厚,不易捣破;
B.过滤时,防止液滴飞溅;
C.分液时,防止液滴飞溅;
D.滴加液体时,防止试剂污染或损失.
解答 解:A.三层滤纸一侧较厚,不易捣破,则过滤操作中,玻璃棒紧靠三层滤纸,故A不选;
B.过滤时,防止液滴飞溅,则过滤操作中,漏斗下端管口紧靠烧杯内壁,故B不选;
C.分液时,防止液滴飞溅,则分液操作中,分液漏斗下端管口紧靠烧杯内壁,故C不选;
D.滴加液体时,防止试剂污染或损失,则用胶头滴管向试管滴加液体时,滴管尖端不能接触试管内壁,应悬空正放,故D选;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24 L乙醇中碳氢键的数目为0.5 NA | |
| B. | 1 L 0.1 mol•L-1硫酸钠溶液中含有的氧原子数为0.4 NA | |
| C. | 0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1 NA | |
| D. | 0.1 mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA |
18.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:汽车内燃机燃烧的高温引起氮气和氧气反应,这是汽车尾气里含有NO气体的原因之一.已知不同温度时,反应N2(g)+O2(g)?2NO(g)的平衡常数.
(1)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志AD.
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(2)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是AC(填字母序号).

(3)在2400℃时向2L密闭容器中充入N2和O2各1mol,平衡时N2的转化率是4%(保留整数);平衡后再向其中充入1molNO,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气中NO的体积分数不变(填“变大”、“变小”或“不变”).
(4)为了减轻大气污染,人们提出通过以下反应来处理汽车尾气2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=a kJ•mol-1,为了测定在某种催化剂作用下该反应的反应速率,t℃时在一等容的密闭容器中,在上述条件下该反应能自发进行,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0).
请回答下列问题:
①a小于0(填“大于”或“小于”).
②假设在密闭容器中发生上述处理汽车尾气反应,达到平衡时改变下列条件,能提高NO转化率的是
CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积.
③t℃时2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数K=5000.
| 温度 | 1760℃ | 2400℃ | 2730℃ |
| 平衡常数 | 2.4×10-4 | 6.4×10-3 | 8.9×10-3 |
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(2)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是AC(填字母序号).

(3)在2400℃时向2L密闭容器中充入N2和O2各1mol,平衡时N2的转化率是4%(保留整数);平衡后再向其中充入1molNO,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气中NO的体积分数不变(填“变大”、“变小”或“不变”).
(4)为了减轻大气污染,人们提出通过以下反应来处理汽车尾气2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=a kJ•mol-1,为了测定在某种催化剂作用下该反应的反应速率,t℃时在一等容的密闭容器中,在上述条件下该反应能自发进行,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0).
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①a小于0(填“大于”或“小于”).
②假设在密闭容器中发生上述处理汽车尾气反应,达到平衡时改变下列条件,能提高NO转化率的是
CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积.
③t℃时2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数K=5000.
8.下列叙述正确的是( )
| A. | Mg、Al、Cu在空气中长时间放置,在其表面均生成氧化物 | |
| B. | 把SO2气体分别通入到BaCl2、Ba(NO3)2溶液中均有白色沉淀生成 | |
| C. | 工业上通常用电解钠、镁、铝对应的熔融氯化物制得该三种金属单质 | |
| D. | 将水蒸气通过灼热的铁粉,反应后固体质量增加 |
15.30mL 5mol/LNaOH溶液中NaOH的质量为( )
| A. | 4g | B. | 5g | C. | 6g | D. | 7g |
12.下列化学实验操作或事故处理方法正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,应立即用稀酸液冲洗 | |
| C. | 酒精灯着火时可用水扑灭 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
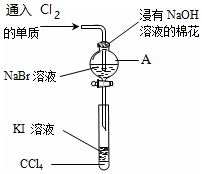 为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,
为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验, 可逆反应A(g)+B(g)?2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.
可逆反应A(g)+B(g)?2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.