题目内容
18.下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )| 离子组 | 加入试剂 | 离子方程式 | |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | SO42-+2NH4++Ba2++2OH-=BaSO4↓+2NH3•5H2O |
| B | Mg2+、HCO3-、Cl-、 | 过量NaOH溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe3+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氧化钡少量,亚铁离子优先反应,铵根离子不反应;
B.氢氧化钠过量,碳酸氢根离子也参与反应;
C.一水合氨按为弱碱,离子方程式中不能拆开;
D.NO3-在酸性条件下具有强氧化性,与HSO3-发生氧化还原反应.
解答 解:A.少量Ba(OH)2溶液,NH4+不能参加反应,正确的离子反应为:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓,故A错误;
B.过量NaOH溶液,生成水、更难溶的氢氧化镁和碳酸钠,反应的离子反应为:Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32-,故B正确;
C.通入少量CO2,只与一水合氨反应,正确的离子反应为:2NH3•H2O+CO2═CO32-+2NH4++H2O,故C错误;
D.NO3-在酸性条件下具有强氧化性,与HSO3-发生氧化还原反应,酸性溶液中NO3-将HSO3-氧化为SO42-,故D错误;
故选B.
点评 本题考查离子共存、离子反应方程式的书写,题目难度中等,明确发生的化学反应是解答本题的关键,注意发生的氧化还原反应为解答的难点,选项BD为解答的易错点,试题有利于提高学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列叙述正确的是( )
| A. | Mg、Al、Cu在空气中长时间放置,在其表面均生成氧化物 | |
| B. | 把SO2气体分别通入到BaCl2、Ba(NO3)2溶液中均有白色沉淀生成 | |
| C. | 工业上通常用电解钠、镁、铝对应的熔融氯化物制得该三种金属单质 | |
| D. | 将水蒸气通过灼热的铁粉,反应后固体质量增加 |
3. 常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )
常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )
 常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )
常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )| A. | 若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=$\frac{1{0}^{-4}}{m+1}$ | |
| B. | 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH | |
| C. | 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO) | |
| D. | b~c段,随NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐增大 |
7.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 光导纤维属于硅酸盐产品 |
8.某电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.该电池是以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是( )
| A. | Zn为电池的正极 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 该电池放电过程中电解质溶液浓度不变 |
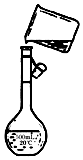 某同学用胆矾晶体(CuSO4•5H2O)配制0.05mol/L的CuSO4溶液980mL,回答下列问题:
某同学用胆矾晶体(CuSO4•5H2O)配制0.05mol/L的CuSO4溶液980mL,回答下列问题: