题目内容
19.实验测得每1g碳充分燃烧生成CO2气体放出32.79kJ的热量.试计算2kg碳充分燃烧生成CO2气体时放出多少热量.分析 燃烧热是指完全燃烧1mol物质生成最稳定产物的过程放出的热量,根据热化学方程式的意义,求2kg碳充分燃烧生成CO2气体时放出的热量,由此分析解答.
解答 解:1g碳充分燃烧生成CO2气体放出32.79kJ的热量,所以2kg碳充分燃烧生成CO2气体时放出:2×103×32.79=6.56×104 kJ,
答:2kg碳充分燃烧生成CO2气体时放出6.56×104 kJ.
点评 本题考查热化学方程式,题目难度不大,注意反应放出的热量与物质的量成正比,比较容易.

练习册系列答案
相关题目
15.下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
| A. | 体积相等时具有的质量相等 | B. | 分子数相等时具有的中子数相等 | ||
| C. | 质量相等时具有的质子数相等 | D. | 体积相等时具有的原子数相等 |
10.下列各组物质的性质顺序,不正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
7.根据题给信息,完成下列各小题:
Ⅰ、某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c(Na+)=4×10-4mol/L,c(SO42-)=2.5×10-4mol/L,c(Cl-)=1.6×10-5 mol/L,c(NO3-)=1.4×10-5 mol/L,c(Ca2+)=1.5×10-5 mol/L,则该废水的pH为4.
Ⅱ、有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大;NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则这四种酸的酸性由强到弱的顺序为HA>HC>HB>HD.
Ⅲ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得
溶液的pH如下表:
请回答:
(1)从①组情况分析,HA是强酸还是弱酸弱酸(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(3)②组情况表明,c大于0.2mol/L(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(4)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
Ⅰ、某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c(Na+)=4×10-4mol/L,c(SO42-)=2.5×10-4mol/L,c(Cl-)=1.6×10-5 mol/L,c(NO3-)=1.4×10-5 mol/L,c(Ca2+)=1.5×10-5 mol/L,则该废水的pH为4.
Ⅱ、有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大;NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则这四种酸的酸性由强到弱的顺序为HA>HC>HB>HD.
Ⅲ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得
溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组情况分析,HA是强酸还是弱酸弱酸(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(3)②组情况表明,c大于0.2mol/L(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(4)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
14.下列说法不正确的是( )
| A. | 化学反应可分为吸热反应和放热反应 | |
| B. | 化学反应的实质是旧键的断裂与新键的生成 | |
| C. | 化学反应中的能量变化都是以热能的形式表现出来 | |
| D. | 放热反应发生时不需加热 |
8.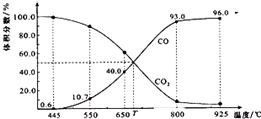 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )
 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )| A. | 550℃时,若充入惰性气体,v正、v逆 均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡不移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.p总 |
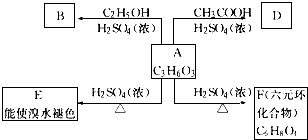
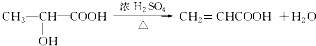 ;A→F
;A→F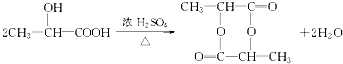
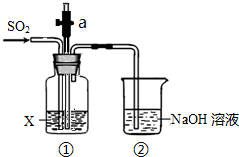 某实验小组用如图所示装置探究SO2的性质.
某实验小组用如图所示装置探究SO2的性质.