题目内容
6.既与盐酸反应又能与氢氧化钠溶液反应的氧化物是( )| A. | Al(OH)3 | B. | Al2O3 | C. | NaHCO3 | D. | Al |
分析 Al、Al2O3、Al(OH)3、弱酸酸式盐、弱酸的铵盐、氨基酸和蛋白质都既能和稀盐酸反应又能和NaOH反应,由两种元素组成且其中一种元素是O元素的化合物是氧化物,据此分析解答.
解答 解:A.氢氧化铝能和稀盐酸、氢氧化钠溶液反应生成盐和水,属于两性氢氧化物,故A错误;
B.氧化铝能和稀盐酸、NaOH溶液反应生成盐和水,所以属于两性氧化物,故B正确;
C.碳酸氢钠是弱酸酸式盐,能和稀盐酸、NaOH溶液反应生成盐,但碳酸氢钠属于盐而不是氧化物,故C错误;
D.铝能和NaOH溶液反应生成盐和氢气,和稀盐酸反应生成盐和氢气,属于金属单质,故D错误;
故选B.
点评 本题考查元素化合物性质及基本概念,明确物质性质及概念内涵是解本题关键,注意物质性质的总结归纳,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
2.己知25℃、101kPa时:4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9kJ•mol-1,4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.1gkJ•mol-1,已知该题中Al与O2的反应中△H=-2834.9kJ•mol-1表示的意义为4molAl(s)与3molO2(g)反应,生成2mol Al2O3(s)放出的能量为2834.9kJ.由此得出的正确结论是( )
| A. | 等质量的O2比O3的能量低,由O2变O3为放热反应 | |
| B. | 等质量的O2比O3的能量高,由O2变O3为吸热反应 | |
| C. | O3比O2稳定,由O2变O3为放热反应 | |
| D. | O2比O3稳定,由O2变O3为吸热反应 |
17.已知:常温下浓度为0.1mol•L-1的下列溶液的pH如表:
下列有关说法正确的是( )
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2c (CO32ˉ)+c (HCO3ˉ)=0.1 mol•L-1 | |
| C. | 根据上表,水解方程式ClOˉ+H2O?HClO+OHˉ的水解常数K≈10ˉ7.6 | |
| D. | 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) |
14.下列说法不正确的是( )
| A. | 化学反应可分为吸热反应和放热反应 | |
| B. | 化学反应的实质是旧键的断裂与新键的生成 | |
| C. | 化学反应中的能量变化都是以热能的形式表现出来 | |
| D. | 放热反应发生时不需加热 |
15.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,22.4 L乙烯中C-H键数为4NA | |
| B. | 1 mol羟基中电子数为10NA | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| D. | 常温下,1 L 0.1 mol•L-1 的NH4NO3溶液中氮原子数为0.2NA |
16.学习一门科学知识,是想利用科学知识解释生活当中的现象以及创造更加美好的生活,某同学学习了蛋白质变性的性质之后,就试着设计方法来对食物进行消毒,其中合理的是( )
| A. | 煮沸水消灭水当中的细菌 | |
| B. | 加强酸或强碱对餐具进行消毒 | |
| C. | 用甲醛气体对食物进行消毒 | |
| D. | 用重金属盐消毒后加牛奶冲洗后再食用 |
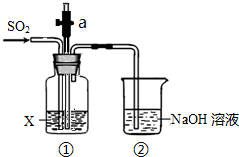 某实验小组用如图所示装置探究SO2的性质.
某实验小组用如图所示装置探究SO2的性质.