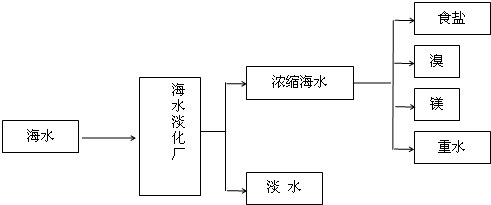
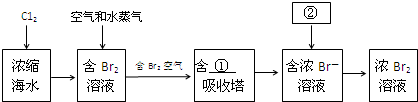
题目内容
Pb及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)铅丹(Pb3O4)可作为防锈用涂料.可用PbO在空气中加热制备,请写出反应的化学方程式 .
(2)Fe3O4可表示为FeO?Fe2O3,则Pb3O4也可相应的表示为 .
(3)废铅蓄电池某极滴入浓盐酸,有黄绿色气体产生,则该电极应为铅蓄电池的 (填“负”或“正”)极,请写出反应的化学方程式 .
(4)用某铅蓄电池来电解水,当两极共产生33.6L(标准状况)气体时该铅蓄电池的正极增重 g.(写出计算过程)
(1)铅丹(Pb3O4)可作为防锈用涂料.可用PbO在空气中加热制备,请写出反应的化学方程式
(2)Fe3O4可表示为FeO?Fe2O3,则Pb3O4也可相应的表示为
(3)废铅蓄电池某极滴入浓盐酸,有黄绿色气体产生,则该电极应为铅蓄电池的
(4)用某铅蓄电池来电解水,当两极共产生33.6L(标准状况)气体时该铅蓄电池的正极增重
考点:原电池和电解池的工作原理,铁的氧化物和氢氧化物
专题:电化学专题,元素及其化合物
分析:(1)PbO在空气中加热生成Pb3O4,根据反应物、生成物及反应条件书写方程式;
(2)Pb在化合物中的化合价有+2价、+4价;
(3)废铅蓄电池某极滴入浓盐酸,有黄绿色气体产生,说明HCl作还原剂,则二氧化铅作氧化剂,二者发生氧化还原反应生成氯气;
(4)电解水方程式为2H2O
2H2↑+O2↑,当两极产生33.6L(标准状况)气体时,转移电子的物质的量=
×
×4=2mol,根据转移电子相等进行计算.
(2)Pb在化合物中的化合价有+2价、+4价;
(3)废铅蓄电池某极滴入浓盐酸,有黄绿色气体产生,说明HCl作还原剂,则二氧化铅作氧化剂,二者发生氧化还原反应生成氯气;
(4)电解水方程式为2H2O
| ||
| 33.6L |
| 22.4L/mol |
| 1 |
| 3 |
解答:
解:(1)PbO在空气中加热生成Pb3O4,反应方程式为12PbO+2O2
4Pb3O4,故答案为:12PbO+2O2
4Pb3O4;
(2)Pb在化合物中的化合价有+2价、+4价,Pb3O4中Pb的平均化合价为+
价,该化合物中+2价Pb与+4价Pb原子个数之比为2:1,所以可表示为2PbO.PbO2,故答案为:2PbO.PbO2;
(3)废铅蓄电池某极滴入浓盐酸,有黄绿色气体产生,说明HCl作还原剂,则二氧化铅作氧化剂,二者发生氧化还原反应生成氯气,二氧化铅得电子作铅蓄电池正极,该反应方程式为PbO2+4HCl(浓)=Cl2↑+PbCl2+2H2O,故答案为:正;PbO2+4HCl(浓)=Cl2↑+PbCl2+2H2O;
(4)电解水方程式为2H2O
2H2↑+O2↑,当两极产生33.6L(标准状况)气体时,转移电子的物质的量=
×
×4=2mol,串联电路中转移电子相等,正极电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,所以该铅蓄电池的正极增重=
×64g/mol=64g,故答案为:64.
| ||
| ||
(2)Pb在化合物中的化合价有+2价、+4价,Pb3O4中Pb的平均化合价为+
| 8 |
| 3 |
(3)废铅蓄电池某极滴入浓盐酸,有黄绿色气体产生,说明HCl作还原剂,则二氧化铅作氧化剂,二者发生氧化还原反应生成氯气,二氧化铅得电子作铅蓄电池正极,该反应方程式为PbO2+4HCl(浓)=Cl2↑+PbCl2+2H2O,故答案为:正;PbO2+4HCl(浓)=Cl2↑+PbCl2+2H2O;
(4)电解水方程式为2H2O
| ||
| 33.6L |
| 22.4L/mol |
| 1 |
| 3 |
| 2mol |
| 2 |
点评:本题考查了氧化还原反应、原电池原理等知识点,根据方程式书写规则、物质的性质、原电池和电解池原理等知识点解答,注意(4)题生成氢气和氧气的物质的量之比,再结合转移电子守恒进行计算,题目难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
油炸虾条、薯片等挤压易碎的食品不宜采用真空包装,一般在包装袋中充入某种气体防止食品被直接挤压,你认为下列气体中不宜充入包装袋的是( )
| A、氮气 | B、空气 | C、氯气 | D、氩气 |
下列说法正确的是( )
| A、增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 |
| B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C、活化分子间所发生的碰撞为有效碰撞 |
| D、升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子的百分数 |
 用铜片、银片、Cu(N03)2溶液、AgN03溶液、导线和盐桥(装有琼胶的KCl饱和溶液)构成一个原电池,下列叙述正确的是( )
用铜片、银片、Cu(N03)2溶液、AgN03溶液、导线和盐桥(装有琼胶的KCl饱和溶液)构成一个原电池,下列叙述正确的是( )| A、负褪羼应为:Ag++e-═Ag |
| B、在外电路中,电子从银电极流向铜电极 |
| C、盐桥中的Cl-移向Cu(N03)2溶液 |
| D、电池总反应为:Cu+2Ag+═Cu2++2Ag |
 工业上在合成塔中采用下列反应合成甲醇:
工业上在合成塔中采用下列反应合成甲醇: