题目内容
2.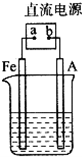 某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题:
某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题:(1)写出a、b电极的正、负:a负极、b正极(填“正”或“负”).
(2)写出A代表物质的化学式Cu,写出电解液的名称硫酸铜溶液,理论上电解质溶液的浓度不变(填“变大”“变小”或“不变”).
(3)写出电极反应式,阴极Cu2++2e-=Cu,阳极Cu-2e-=Cu2+.
分析 铁制品镀铜,铜应作阳极,铁作阴极,电解质溶液为硫酸铜溶液,据此分析解答.
解答 解:(1)铁制品镀铜,铜应作阳极,接电源正极,铁作阴极,接电源负极,则a为负极,b为正极,
故答案为:负;正;
(2)铁制品镀铜,铜应作阳极,电极反应式为:Cu-2e-=Cu2+,铁作阴极,电极反应式为:Cu2++2e-=Cu,电解质溶液为硫酸铜溶液,则A代表物质的化学式Cu,理论上电解质溶液的浓度不变,
故答案为:Cu;硫酸铜溶液;不变;
(3)铁制品镀铜,铜应作阳极,电极反应式为:Cu-2e-=Cu2+,铁作阴极,电极反应式为:Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;Cu-2e-=Cu2+.
点评 本题主要考查电解原理的应用铁制品镀铜,题目难度不大,掌握电解的基本原理是解题的关键.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
13.某状况下,3.2g O2的体积为2.5L,在该状况下,将NO2与O2按4:1的体积比充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升后,最后烧瓶内溶液的物质的量浓度为( )
| A. | 0.032mol•L-1 | B. | 0.036mol•L-1 | C. | 0.04mol•L-1 | D. | 0.045mol•L-1 |
7.BF3与一定量的水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:
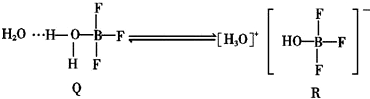
反应过程中新形成的化学键中无( )

反应过程中新形成的化学键中无( )
| A. | 离子键 | B. | 配位键 | C. | 非极性共价键 | D. | 氢键 |
14.茶叶中铁元素的检测可经过以下A、B、C、D四个步骤完成,各步骤中选用的实验仪器不会全部都用上的是( )
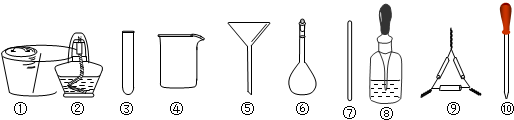

| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的Fe3+,选用③和⑧ |
11.在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态的是( )
①混合气体的平均相对分子质量; ②混合气体的密度; ③B的物质的量浓度;
④气体总物质的量; ⑤混合气体的压强 ⑥C、D反应速率的比值.
①混合气体的平均相对分子质量; ②混合气体的密度; ③B的物质的量浓度;
④气体总物质的量; ⑤混合气体的压强 ⑥C、D反应速率的比值.
| A. | ②③⑤ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ①②③ |
12.现有5.2g Fe和Cu的混合物,向其中加入足量浓硝酸,完全反应后,收集到0.2mol NO2和0.03mol N2O4气体,再向所得溶液中加入1mol/L NaOH溶液得到mg沉淀,下列有关说法正确的是( )
| A. | 混合物中Fe和Cu的物质的量之比为3:2 | |
| B. | 消耗NaOH溶液体积为260mL | |
| C. | 所得沉淀的质量m=9.83g | |
| D. | 混合物消耗HNO3的物质的量为0.46mol |
 A、B、C三种固体物质的溶解度曲线如图所示.
A、B、C三种固体物质的溶解度曲线如图所示.
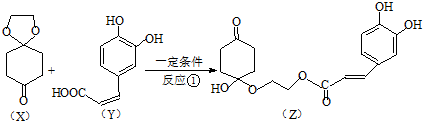
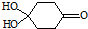 )分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
)分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如:
(已知烯醇式不稳定,会发生分子重排,例如: ).
).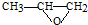 )发生类似反应①的反应,其生成物的结构简式为
)发生类似反应①的反应,其生成物的结构简式为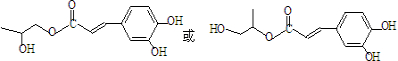 (写一种);
(写一种);