题目内容
13.某状况下,3.2g O2的体积为2.5L,在该状况下,将NO2与O2按4:1的体积比充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升后,最后烧瓶内溶液的物质的量浓度为( )| A. | 0.032mol•L-1 | B. | 0.036mol•L-1 | C. | 0.04mol•L-1 | D. | 0.045mol•L-1 |
分析 某状况下,3.2g O2的体积为2.5L,该条件下的气体摩尔体积为:$\frac{2.5L}{\frac{3.2g}{32g/mol}}$=25L/mol;
发生反应:4NO2+O2+2H2O=4HNO3,气体完全反应,所得溶液的体积等于烧瓶的容积等于混合气体的体积,设体积为1L,计算二氧化氮的体积,再根据n=$\frac{V}{{V}_{m}}$计算二氧化氮的物质的量,计算硝酸的物质的量,最后根据c=$\frac{n}{V}$计算所得硝酸溶液的浓度.
解答 解:某状况下,3.2g O2的体积为2.5L,该条件下的气体摩尔体积为:$\frac{2.5L}{\frac{3.2g}{32g/mol}}$=25L/mol,
设混合气体的总体积为1L,则二氧化氮的体积为$\frac{4}{5}$L,物质的量为:$\frac{\frac{4}{5}L}{25L/mol}$=$\frac{4}{125}$mol=0.032mol,由4NO2+O2+2H2O=4HNO3可知n(HNO3)=0.032mol,气体完全反应,所得溶液的体积等于烧瓶的容积等于混合气体的体积,
故所得硝酸溶液的物质的量浓度为:c(HNO3)=$\frac{0.032mol}{1L}$=0.032mol•L-1,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确计算该条件下气体摩尔体积的数值为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
4.四种仪器中,不能用来加热的是( )
| A. |  | B. |  | C. |  | D. |  |
8.现有下列短周期元素性质的数据:
试回答下列问题:
(1)上述元素中处于同一主族的有④和⑦、③和⑥,处于第3周期的有②④⑤⑥(以上均用 编号表示).
(2)元素④与元素⑦相比较,气态氢化物较稳定的是NH3(填气态氢化物的化学式).
(3)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与CO2反应的化学方程式:2Na2O2+2CO2=Na2CO3+O2;
(4)上表中某元素最高价氧化物对应的水化物能溶于盐酸和氢氧化钠,该元素的单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素编号元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于同一主族的有④和⑦、③和⑥,处于第3周期的有②④⑤⑥(以上均用 编号表示).
(2)元素④与元素⑦相比较,气态氢化物较稳定的是NH3(填气态氢化物的化学式).
(3)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与CO2反应的化学方程式:2Na2O2+2CO2=Na2CO3+O2;
(4)上表中某元素最高价氧化物对应的水化物能溶于盐酸和氢氧化钠,该元素的单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
18.下列物质的电离方程式正确的是( )
| A. | H2CO3?2H++CO32- | B. | HClO+H2O?H3O++ClO- | ||
| C. | NaHCO3?Na++HCO3- | D. | 在熔化时NaHSO4═Na++H++SO42- |
5.下列离子方程式正确的是( )
| A. | 向NaOH溶液中通入过量的SO2:SO2+20H-═SO32-+H20 | |
| B. | Na2O2和H2O反应:Na2O2+H2O═2Na++20H-+02↑ | |
| C. | Cl2和H2O反应:Cl2+H20═2H++Cl-+Cl0- | |
| D. | SiO2+2OH-═SiO32-+H2O |
3.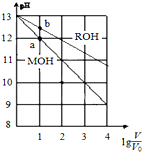 pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
 pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | MOH的物质的量浓度大于ROH | |
| B. | 水的电离程度:b点大于a点 | |
| C. | 两溶液在稀释过程中,溶液中各离子浓度都减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减少 |
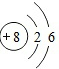 ;
; ;
;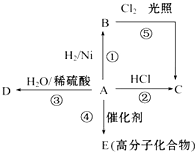 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: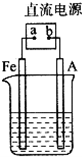 某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题:
某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题: