题目内容
10.实验室制取氯气如图,连接好实验装置.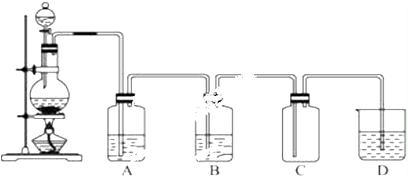
请回答下列问题:
(1)图中气体发生装置中盛放浓盐酸的仪器名称是圆底烧瓶其中发生反应的离子方程式为MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+Cl2↑+Mn2+;
(2)A中盛放的是饱和食盐水,其作用为除去HCl.
(3)B中盛放的是浓H2SO4,其作用为干燥Cl2.
(4)D中盛放的是NaOH溶液,化学反应方程式Cl2+2NaOH=NaCl+NaClO+H2O.
分析 实验室用加热固体二氧化锰与浓盐酸方法制取氯气,二者反应生成氯气、氯化锰和水,浓盐酸易挥发,所以制备的氯气中含有氯化氢、水蒸气杂质,要得到纯净的氯气,需要除去氯化氢、水蒸气,依据氯气、氯化氢在饱和食盐水溶解度不同选择合适试剂除去氯化氢,依据浓硫酸具有吸水性,选择氯气干燥剂,氯气有毒,直接排放到空气中能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气,据此解答.
解答 解:(1)依据仪器形状可知:盛放浓盐酸的仪器为圆底烧瓶,二氧化锰、浓盐酸在加热条件下生成氯气、氯化锰和水,离子方程式为MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+Cl2↑+Mn2+
故答案为:圆底烧瓶;MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+Cl2↑+Mn2+;
(2)浓盐酸易挥发,所以制备的氯气中含有氯化氢、水蒸气杂质,要得到纯净的氯气,需要除去氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以选择盛有饱和食盐水的A除去氯气中的氯化氢;
故答案为:饱和食盐水:除去HCl;
(3)浓硫酸具有吸水性,能够干燥氯气;
故答案为:浓H2SO4;干燥Cl2;
(4)氯气有毒,直接排放到空气中能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O,可以用氢氧化钠溶液吸收过量的氯气;
故答案为:NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查了氯气的实验室制备,明确氯气制备原理及氯气的性质是解题关键,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
18.下列物质的电离方程式正确的是( )
| A. | H2CO3?2H++CO32- | B. | HClO+H2O?H3O++ClO- | ||
| C. | NaHCO3?Na++HCO3- | D. | 在熔化时NaHSO4═Na++H++SO42- |
5.下列离子方程式正确的是( )
| A. | 向NaOH溶液中通入过量的SO2:SO2+20H-═SO32-+H20 | |
| B. | Na2O2和H2O反应:Na2O2+H2O═2Na++20H-+02↑ | |
| C. | Cl2和H2O反应:Cl2+H20═2H++Cl-+Cl0- | |
| D. | SiO2+2OH-═SiO32-+H2O |
20.下列关系式中正确的是( )
| A. | 同一原子中,轨道的能量高低:1s>2s>3s>4s | |
| B. | 同一原子中,轨道的能量高低:3s<3p<3d | |
| C. | 不同能级中含有的原子轨道数:s-2;p-6;d-10 | |
| D. | M层上所具有的原子轨道数共有9个 |
 ,X属于共价化合物.
,X属于共价化合物. .
.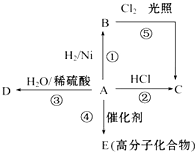 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
 .
.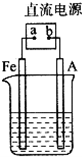 某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题:
某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题: