题目内容
20.现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡向右移动(填“向左”、“向右”或“不”);另取10mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将减小(填“增大”、“减小”或“无法确定”).
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)小于pH(乙)(填“大于”、“小于”或“等于”).
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)大于V(乙) (填“大于”、“小于”或“等于”).
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)小于c(CH3COO-)(填“大于”、“小于”或“等于”).
(5)各取25mL的甲、乙两溶液,加入足量的锌粉,产生氢气的体积V(甲)大于V(乙) (填“大于”、“小于”或“等于”).
分析 (1)加水稀释促进醋酸电离,加入含有醋酸根离子的物质抑制醋酸电离;
(2)相同条件下加水稀释醋酸促进醋酸电离;
(3)等pH的醋酸和盐酸,醋酸的浓度大于盐酸,中和相同浓度的NaOH溶液时,消耗NaOH溶液体积与酸的物质的量成正比;
(4)pH=2的醋酸浓度大于0.01mol/L,PH=12的NaOH溶液浓度为0.01mol/L,二者等体积混合,醋酸过量,导致溶液呈酸性,再结合电荷守恒判断;
(5)醋酸是弱电解质,不能完全电离,而HCl是强电解质,能完全电离.
解答 解:(1)醋酸是弱电解质,加水稀释促进醋酸电离,则电离平衡向向右移动;向醋酸中加入醋酸钠固体,导致溶液中醋酸根离子浓度增大,抑制醋酸电离,溶液中醋酸分子个数增大,氢离子个数减小,所以溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值减小,
故答案为:向右;减小;
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍,稀释过程中,醋酸继续电离出氢离子,氯化氢完全电离,导致稀释后的溶液醋酸中氢离子浓度大于盐酸,所以其pH大小关系为:pH(甲)小于pH(乙),故答案为:小于;
(3)中和相同浓度的NaOH溶液时,消耗NaOH溶液体积与酸的物质的量成正比,等pH的醋酸和盐酸,醋酸的浓度大于盐酸,所以等体积等PH的醋酸和盐酸,醋酸的物质的量大于盐酸,则醋酸消耗的NaOH体积大于盐酸,故答案为:大于;
(4)pH=2的醋酸浓度大于0.01mol/L,PH=12的NaOH溶液浓度为0.01mol/L,二者等体积混合,醋酸过量,导致溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Na+)<c(CH3COO-),故答案为:小于;
(5)醋酸是弱电解质,不能完全电离,而HCl是强电解质,能完全电离,故25mLpH=2的醋酸溶液和pH=2的盐酸中氢离子的物质的量甲>乙,故加入足量的锌后,产生氢气的体积甲大于乙,故答案为:大于.
点评 本题考查了弱电解质的电离,明确弱电解质的电离特点、弱电解质的影响因素等知识点来分析解答,离子浓度大小比较时要明确溶液中的溶质及其性质,再结合电荷守恒来判断,为易错点.

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
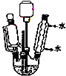
全能闯关100分系列答案| A. |  装置所示装置可实现反应:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 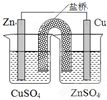 装置能构成锌铜原电池 | |
| C. | 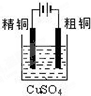 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于在实验室测定中和反应的反应热 |
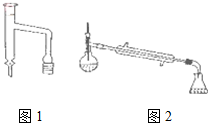 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下: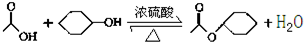
 | 相对分子质量 | 密度/g•cm-3 | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
将12.0g(0.2mol)乙酸、l0.0g(0.1mol)环己醇和15mL环己烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL 98%浓硫酸,滴加完后将恒压滴液漏斗换成分水器装置,加热回流90min后,向反应液中依次加入水、10%的NaHCO3溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏,收集168-174℃的馏分,得到无色透明、有香味的液体产品6.9g
(1)上述反应装置图中存在的一处错误是冷凝水应从下口进上口出.
(2)实验中控制乙酸的物质的量是环己醇的2倍,其目的是提高环已醇的转化率.
(3)分水器(图1)的作用是将生成的水及时从体系中分离出来,提高反应物的转化率.
(4)用l0%的NaHCO3溶液洗涤的目的是洗去硫酸和醋酸;第二次水洗的目的是洗去碳酸氢钠;加入无水MgSO4的目的是干燥.
(5)本次实验的产率为48.6%.(保留3位有效数字)
(6)若在进行蒸馏操作时,采用图2装置,会使实验的产率偏高
(填“偏高”或“偏低”),其原因是产品中会收集到未反应的环己醇.
| A. | 钠能与硫酸铜稀溶液反应,置换出红色的铜 | |
| B. | 为了消除碘缺乏病,在食用盐中必须加入一定量的单质碘 | |
| C. | 过氧化钠是淡黄色固体,可用作呼吸面具的供氧剂 | |
| D. | 氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰 |
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
②一定浓度的A、B的溶液中水的电离程度可以相同;
③C溶液和D溶液相遇时只生成白色沉淀;
④仅B溶液和C溶液相遇时只生成刺激性气味的气体;
⑤A溶液和D溶液混合时无现象.
(1)写出A物质中所含化学键的类型离子键、共价键(或离子键、极性键和非极性键).
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓.
(3)25℃时,0.1mol•L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3•H20)=10 a-14(用含有a的关系式表示).
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(5)25℃时,在一定体积的0.01mol•L-1的C溶液中,加入一定体积的0.01mol•L-1的盐酸,混合溶液的pH=12,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是2:1.
| A. | 分子式为C3H6O的有机化合物性质相同 | |
| B. | 现在“点石成金”术石墨变成金刚石属于物理变化 | |
| C. | 过氧化钠与水反应成1mol氧气转移4mol电子 | |
| D. | 工业上冶炼铝时加入冰晶石的作用是降低氧化铝的熔融温度 |
| A. | NH4+、Fe2+、Cl-、SO42- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Mg2+、K+、H+、SO42- | D. | K+、Ca2+、HCO3-、Cl- |
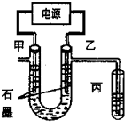 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题: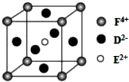 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):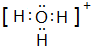 .
.