题目内容
(12分)(1)某一反应体系中有反应物和生成物共5种物质: 、
、 、
、 、
、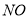 、
、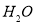 。则该反应中还原产物是______ ;若反应过程中转移了0.3
。则该反应中还原产物是______ ;若反应过程中转移了0.3 电子,则氧化产物的质量_____
电子,则氧化产物的质量_____ 。
。
(2)将a mol Cl2 通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,写出另2个可能发生的离子方程式。
①当 a / b =1时____________________________________________ ;
②当a / b≥3/2时____________________________________________ 。
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3 +H2O Al(OH)4― + H+ ;②NH3+H2O
Al(OH)4― + H+ ;②NH3+H2O NH4+ + OH―
NH4+ + OH―
(A)已知B(OH)3是一元弱酸,试写出其电离方程式:__________________________;
(B)N2H4是二元弱碱,试写出其第二步电离方程式:_______________________________。
(1)NO 4.8g (2) ①2Cl2 + 2Fe2+ + 2Br― = 4Cl―+ 2Fe3+ + Br2
②3Cl2 + 2Fe2+ + 4Br―= 2Fe3+ + 2Br2 + 6Cl―
(3)B(OH)3+H2O  B(OH)4-+H+ N2H5++H2O
B(OH)4-+H+ N2H5++H2O N2H62++OH-
N2H62++OH-
【解析】
试题解析:(1)可根据常见的氧化剂和还原剂来判断HNO3为氧化剂,H2S为还原剂,则NO为还原产物,S为氧化产物。S元素由-2价升高到0价,N元素由+5价降到+2价,应用得失电子守恒规律和观察法配平化学方程式。当生成1mol S时转移2 mol电子,当转移0.3 mol电子生成0.15 mol S,质量为=0.15mol×32g/mol=4.8g;(2)FeBr2的溶液中,还原性Fe2+ >Br― ,所以通入氯气,Fe2+ 先被氯气氧化,反应完后再通氯气,Br― 被氧化。所以当0< a / b≤1/2时,只有Fe2+ 被氧化,所以发生反应2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ;当 a / b =1时,Fe2+ 全部被氧化,Br― 是Fe2+ 的2倍,只有1半被氧化,所以发生的反应方程式为2Cl2 + 2Fe2+ + 2Br― = 2Fe3+ + Br2 + 4Cl― ;当a / b≥3/2时,Fe2+ 、Br―全部被氧化,所以反应为3Cl2 + 2Fe2+ + 4Br― = 2Fe3+ + 2Br2 + 6Cl― ;(3)(A)因为B(OH)3是一元弱酸,所以类似氢氧化铝(偏铝酸)的电离:Al(OH)3 +H2O  Al(OH)4-+ H+ ,所以B(OH)3 应该是与水作用,也生成酸根离子:B(OH)3+H2O
Al(OH)4-+ H+ ,所以B(OH)3 应该是与水作用,也生成酸根离子:B(OH)3+H2O  B(OH)4― + H+ ; (B)N2H4是二元弱碱,则根据②可知,电离方程式为N2H4+H2O
B(OH)4― + H+ ; (B)N2H4是二元弱碱,则根据②可知,电离方程式为N2H4+H2O  N2H5+ +OH-、N2H5+ + H2O
N2H5+ +OH-、N2H5+ + H2O N2H62+ +OH-。
N2H62+ +OH-。
考点:氧化还原反应方程式配平与计算和弱电解质的电离

下述实验不能达到预期实验目的的是
选项 | 实验内容 | 实验目的 |
A | 将2.5 g CuSO4·5H2O溶解在97.5 g 水中 | 配制质量分数为1.6%的CuSO4溶液 |
B | 向盛有1 mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 取少量待检固体溶于水中,滴加少量Ba(OH)2溶液,观察是否有白色沉淀生成 | 检验NaHCO3固体中是否含Na2CO3 |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出 |