题目内容
(7分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复):H+、Na+、A13+、Ag+、Ba2+、 OH—、C1—、CO32—、NO3—、SO42—已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。③D溶液与另外四种溶液反应都能产生沉淀。④在E溶液中逐滴加入B溶液,溶液先出现沉淀,当滴加至过量时,沉淀部分溶解。试回答下列问题:
(1)A、C的化学式分别为 、 。
(2)A溶液呈碱性的原因 (用离子方程式表示)。
(3)在100mL0.1mol·L-1的E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀的物质的量为
mol。
(1)Na2CO3、HCl(各2分)
(2)CO32-+H2O HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O H2CO3+OH- (2分) (3)0.01mol(3分)
H2CO3+OH- (2分) (3)0.01mol(3分)
【解析】
试题分析:(1)由于Ag+只能与NO3-共存,所以一定含有硝酸银,硝酸银溶液显酸性。A溶液与E溶液反应既有气体又有沉淀产生,所以根据离子可知,该沉淀应该是氢氧化铝,气体是CO2。由于E溶液显酸性,所以E中含有Al3+,A中含有CO32-。根据阳离子的种类可知,A应该是碳酸钠。A溶液与C溶液反应只有气体产生,这说明C中含有氢离子,所以D是硝酸银。D溶液与另外四种溶液反应都能产生沉淀,所以C只能是HCl。在E溶液中逐滴加入B溶液,溶液先出现沉淀,当滴加至过量时,沉淀部分溶解,则E就是硫酸铝,因此B是氢氧化钡;
(2)碳酸根水解溶液显碱性,方程式为CO32-+H2O HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O H2CO3+OH-;
H2CO3+OH-;
(3)n(Al2(SO4)3)=0.1L×0.1mol/L=0.01mol,n(NaOH)=0.035L×2mol/L=0.07mol;则n(Al3+)=0.02mol,n(OH-)=0.07mol,发生:
Al3+ + 3OH-=Al(OH)3↓
0.02mol 0.06mol 0.02mol
Al(OH)3+OH-=AlO2-+2H2O
0.01mol 0.01mol
所以反应后,生成0.01molAl(OH)3和0.01molAlO2-,得到沉淀物质的量为0.01mol。
考点:考查离子检验、离子共存的有关判断

在150℃时,(NH4)2CO3分解的方程式为:(NH4)2CO3 2NH3↑+H2O↑+CO2↑,若完全分解,产生的气态混合物的密度是相同条件下氢气密度的
2NH3↑+H2O↑+CO2↑,若完全分解,产生的气态混合物的密度是相同条件下氢气密度的
A.96倍 B.48倍 C.12倍 D.10倍
下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如下图所示),一定没有沉淀生成的是 ( )

| X | Y | Z |
A | NO2 | SO2 | BaC12 |
B | NH3 | O2 | A12(SO4)3 |
C | NH3 | CO2 | CaC12 |
D | CO2 | SO2 | CaC12 |

 、
、 、
、 、
、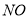 、
、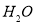 。则该反应中还原产物是______ ;若反应过程中转移了0.3
。则该反应中还原产物是______ ;若反应过程中转移了0.3 电子,则氧化产物的质量_____
电子,则氧化产物的质量_____ 。
。 Al(OH)4― + H+ ;②NH3+H2O
Al(OH)4― + H+ ;②NH3+H2O