题目内容
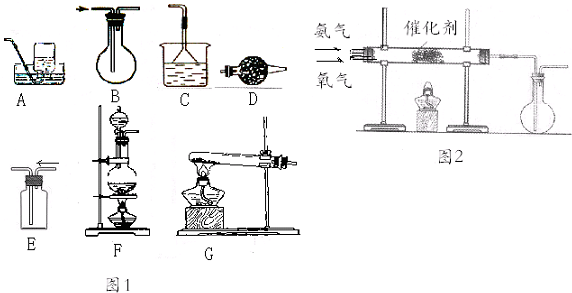
3.用如图所示装置,必要时可加热试管,不能达到实验目的是( )
| A. | 试管中盛酚酞试液,验证氨气的水溶液呈碱性 | |
| B. | 试管中盛酸性高锰酸钾溶液,探究乙烯的还原性 | |
| C. | 试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 | |
| D. | 试管中盛氢硫酸,验证SO2的氧化性 |
分析 A.酚酞遇碱变红;
B.高锰酸钾与乙烯发生氧化反应;
C.CO2与NaOH反应的产物,若生成碳酸钠与NaOH不反应,若生成碳酸氢钠与NaOH反应生成碳酸钠和水;
D.二氧化硫与氢硫酸反应生成S和水.
解答 解:A.酚酞遇碱变红,则试管中盛酚酞试液,注射器中为氨水,可验证氨气的水溶液呈碱性,故A正确;
B.高锰酸钾与乙烯发生氧化反应,则试管中盛酸性高锰酸钾溶液,注射器中为乙烯,可探究乙烯的还原性,故B正确;
C.CO2与NaOH反应的产物,若生成碳酸钠与NaOH不反应,若生成碳酸氢钠与NaOH反应生成碳酸钠和水,现象均不明显,图中装置不能验证CO2与NaOH反应的产物,故C错误;
D.二氧化硫与氢硫酸反应生成S和水,则试管中盛氢硫酸,注射器中为二氧化硫,可验证SO2的氧化性,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
相关题目
20.已知25℃时H2SO3 和H2CO3的电离平衡常数(电离平衡常数越大,酸的电离程度越大),有关 ①100mL 0.1mol/L NaHCO3、②100mL 0.1mol/LNaHSO3两种溶液的叙述正确的是( )
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
| A. | 溶液中水电离出的OHˉ个数:①<② | |
| B. | 溶液中分子的微粒数:H2SO3<H2CO3 | |
| C. | 溶液①中:c(Na+)>c(HCO3-)>c(OHˉ)>c(CO32-)>c(H+) | |
| D. | 溶液②中:c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OHˉ) |
14.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.1mol/L BaCl2溶液中含Cl-数目为0.2NA | |
| B. | 2.8gN2和CO的混合气体中含原子数目0.2NA | |
| C. | 5.6gFe在足量氯气中燃烧,转移电子数目0.2NA | |
| D. | 标况下2.24LCH3COOH中含碳原子数目为0.2NA |
11.下列关于化学键与化合物的叙述正确的是( )
①离子化合物中一定含有金属元素,共价化合物中一定不含有金属元素
②离子化合物中一定含有离子键,可能含有共价键
③共价化合物中一定含极性共价键,一定不含非极性共价键
④由共价键形成的物质一定是共价化合物
⑤单质中一定含有化学键.
①离子化合物中一定含有金属元素,共价化合物中一定不含有金属元素
②离子化合物中一定含有离子键,可能含有共价键
③共价化合物中一定含极性共价键,一定不含非极性共价键
④由共价键形成的物质一定是共价化合物
⑤单质中一定含有化学键.
| A. | ①⑤ | B. | ② | C. | ②③ | D. | ②④ |
18.下列铁的化合物可以分别通过化合反应、置换反应、复分解反应生成的是( )
| A. | FeCl2 | B. | Fe3O4 | C. | Fe(OH)3 | D. | Fe2(SO4)3 |
15.生活中常用一些化学知识,下列分析或结论正确的是( )
| A. | 加碘食盐中添加的是碘化钾 | |
| B. | 将甲醛稀溶液喷在白菜上可以保鲜 | |
| C. | 牛奶中掺入三聚氰胺可以提高蛋白质含量 | |
| D. | 人体中维持血液的pH值稳定的主要离子是HCO3- |
 ,Na2O2中的化学键类型有离子键和非极性共价键;
,Na2O2中的化学键类型有离子键和非极性共价键;