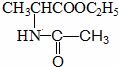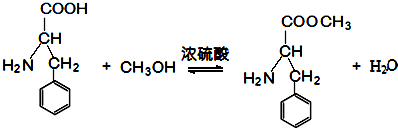题目内容
14.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 0.1mol/L BaCl2溶液中含Cl-数目为0.2NA | |
| B. | 2.8gN2和CO的混合气体中含原子数目0.2NA | |
| C. | 5.6gFe在足量氯气中燃烧,转移电子数目0.2NA | |
| D. | 标况下2.24LCH3COOH中含碳原子数目为0.2NA |
分析 A.溶液体积未知;
B.根据氮气和CO的摩尔质量均为28g/mol来计算;
C.铁与氯气反应生成氯化铁;
D.气体摩尔体积使用对象为气体.
解答 解:A.溶液体积未知,无法计算氯离子个数,故A错误;
B.氮气和CO的摩尔质量均为28g/mol,故2.8g氮气和CO的混合气体的物质的量n=$\frac{m}{M}$=$\frac{2.8g}{28g/mol}$=0.1mol,而氮气和CO均为双原子分子,故0.1mol混合气体含0.2mol原子,故B正确;
C.5.6gFe在足量氯气中燃烧生成0.1mol氯化铁,转移电子数目0.3NA,故C错误;
D.标况下,醋酸不是气体,不能使用气体摩尔体积,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,注意铁与氯气反应生成产物为三价铁,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.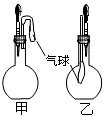 甲、乙两个装置中(如图),胶头滴管分别吸有某液体,平底烧瓶中置有其他物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).所用试剂分别是( )
甲、乙两个装置中(如图),胶头滴管分别吸有某液体,平底烧瓶中置有其他物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).所用试剂分别是( )
 甲、乙两个装置中(如图),胶头滴管分别吸有某液体,平底烧瓶中置有其他物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).所用试剂分别是( )
甲、乙两个装置中(如图),胶头滴管分别吸有某液体,平底烧瓶中置有其他物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).所用试剂分别是( )| A. | 甲:浓硫酸和木炭 乙:浓氨水和SO2 | |
| B. | 甲:双氧水和MnO2 乙:NaOH溶液和CO2 | |
| C. | 甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 | |
| D. | 甲:浓硫酸和蔗糖(滴有几滴水) 乙:水和氨气 |
12.下列关于含硫化合物的叙述不正确的是( )
| A. | SO2能与CaO反应,可用生石灰作工业废气的脱硫剂 | |
| B. | SO2能使碘的淀粉溶液由蓝色变为无色,体现出漂白性 | |
| C. | 浓硫酸和Na2SO3反应制取SO2时,浓硫酸只表现酸性 | |
| D. | 医疗上曾用硫酸钡作X射线透视肠胃的内服药剂 |
2.当光束通过下列分散系时,能产生丁达尔效应的是( )
| A. | 稀豆浆 | B. | 氯化钠溶液 | C. | CuSO4溶液 | D. | KMnO4溶液 |
9.下列离子在强酸性溶液中能大量共存的一项是( )
| A. | Na+、K+、OH-、CH3COO- | B. | Na+、Ba2+、CO32-、NO3- | ||
| C. | Na+、NH4+、Cl-、HCO 3- | D. | Fe3+、K+、SO42-、NO3- |
19.下列物质有固定元素组成的是( )
| A. | 空气 | B. | 干冰 | C. | 氨水 | D. | 氯酸钾 |
6.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜2Cu2S+Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑.对于该反应,下列说法中正确的是( )
| A. | 该反应中的氧化剂是Cu2O | |
| B. | 氧化产物和还原产物的物质的量之比为1:6 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | Cu2S在反应中仅做氧化剂 |
3.用如图所示装置,必要时可加热试管,不能达到实验目的是( )
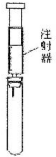

| A. | 试管中盛酚酞试液,验证氨气的水溶液呈碱性 | |
| B. | 试管中盛酸性高锰酸钾溶液,探究乙烯的还原性 | |
| C. | 试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 | |
| D. | 试管中盛氢硫酸,验证SO2的氧化性 |
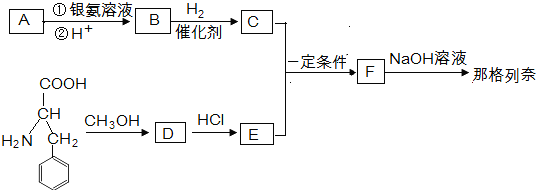
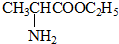 +HCl→
+HCl→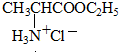
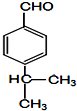
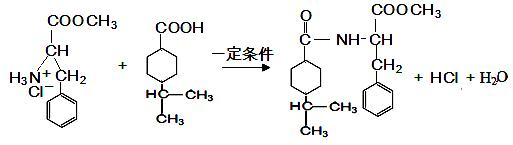
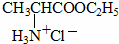 $→_{一定条件}^{CH_{3}COOH}$
$→_{一定条件}^{CH_{3}COOH}$