题目内容
8.H2O2是绿色氧化剂,且酸性介质下由更强的氧化性,易溶于水显弱酸性,常温下K1=1×10-12,K2=1×10-25,回答下列问题:(1)常温下水的电离平衡的常数K约为56×10-14,K、K1、K2从大到小顺序为K1>K>K2;
(2)在硫酸亚铁存在条件下,H2O2溶液可以把苯(C6H6)氧化为苯酚(C6H5OH),反应后的混合物经过分液、蒸馏得到苯酚,理论上制取1mol苯酚需要消耗H2O21mol,实际消耗大于理论用量的主要原因是苯酚不稳定易被氧化
(3)K4[Fe(CN)6](黄色溶液)、K3[Fe(CN)6](黄绿色溶液)与一定量H2O2组成的混合物,用酸或碱调节混合溶液的pH,会出现黄色、黄绿色交替变化,按照从酸性至碱性的顺序,可观察到的现象是溶液由黄绿色变为黄色;
(4)工业用H2O2除去废水中的Cl2,氧化产物是O2;与SO2除Cl2相比,其优点是过量除杂试剂H2O2不会排出有毒气体,且废水酸性较弱.
分析 (1)常温下水的电离平衡的常数K约为56×10-14,H2O2的K1=1×10-12,K2=1×10-25;
(2)发生H2O2+C6H6$\stackrel{FeSO_{4}}{→}$C6H5OH+H2O,苯酚、苯与水分层,苯酚不稳定易被氧化;
(3)由2H++[Fe(CN)6]4-(黄色溶液)+H2O2?[Fe(CN)6]3-(黄绿色溶液)+2H2O,酸性条件下平衡正向移动,碱性条件下平衡逆向移动;
(4)结合H2O2+Cl2=2HCl+O2、Cl2+SO2+2H2O=H2SO4+2HCl分析.
解答 解:(1)常温下水的Kw=1×10-14,则电离平衡的常数K约为56×10-14,H2O2的K1=1×10-12,K2=1×10-25,K、K1、K2从大到小顺序为K1>K>K2,
故答案为:56×10-14;K1>K>K2;
(2)发生H2O2+C6H6$\stackrel{FeSO_{4}}{→}$C6H5OH+H2O,苯酚、苯与水分层,反应后的混合物经过分液、蒸馏得到苯酚,由反应可知,理论上制取1mol苯酚需要消耗H2O2 为1mol,实际消耗大于理论用量的主要原因是苯酚不稳定易被氧化,则消耗的过氧化氢就多,
故答案为:分液;1;苯酚不稳定易被氧化;
(3)由2H++[Fe(CN)6]4-(黄色溶液)+H2O2?[Fe(CN)6]3-(黄绿色溶液)+2H2O,酸性条件下平衡正向移动,碱性条件下平衡逆向移动,则按照从酸性至碱性的顺序,可观察到的现象是溶液由黄绿色变为黄色,
故答案为:溶液由黄绿色变为黄色;
(4)用H2O2除去废水中的Cl2,发生H2O2+Cl2=2HCl+O2可知,O元素失去电子,对应氧化产物为O2,SO2除去废水中的Cl2,发生Cl2+SO2+2H2O=H2SO4+2HCl,则与SO2除Cl2相比,其优点是过量除杂试剂H2O2不会排出有毒气体,且废水酸性较弱,
故答案为:O2;过量除杂试剂H2O2不会排出有毒气体,且废水酸性较弱.
点评 本题考查化学平衡及氧化还原反应,为高频考点,把握物质的性质、化学平衡常数及平衡移动为解答的关键,侧重分析与应用能力的考查,注意反应原理的应用,题目难度中等.

| A. | 配制一定浓度的稀硫酸,用量筒量取浓硫酸后,未将蒸馏水洗涤量筒后的洗涤液转移至容量瓶中,使配制的溶液浓度偏小 | |
| B. | pH试纸使用时不需要润湿,红色石蕊试纸检测气体时也不需要润湿 | |
| C. | 蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| D. | 石油的蒸馏实验中,忘记加沸石,可以先停止加热,待溶液冷却后加入沸石,再继续加热蒸馏 |
| A. | 空气 | B. | 干冰 | C. | 氨水 | D. | 氯酸钾 |
| A. | 食盐 | B. | 油脂 | C. | 氨基酸 | D. | 蛋白质 |
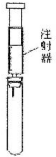
| A. | 试管中盛酚酞试液,验证氨气的水溶液呈碱性 | |
| B. | 试管中盛酸性高锰酸钾溶液,探究乙烯的还原性 | |
| C. | 试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 | |
| D. | 试管中盛氢硫酸,验证SO2的氧化性 |
| A. | 室温下,NaR溶液的pH大于7 | |
| B. | 25℃时,0.01mol/L的HR溶液pH=2.8 | |
| C. | 加热NaR溶液时,溶液的pH变小 | |
| D. | HR溶液加入少量NaR固体,溶解后溶液的pH变大 |
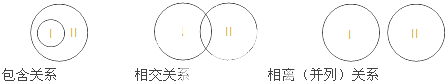
下列概念间关系判断正确的是( )
| 概念I | 概念II | 相互关系 | |
| A | 共价分子 | 共价化合物 | 包含关系 |
| B | 分解反应 | 吸热反应 | 包含关系 |
| C | 非金属氧化物 | 酸性氧化物 | 相交关系 |
| D | 离子互换反应 | 氧化还原反应 | 相离(并列)关系 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 4s2 | B. | 3d54s2 | C. | 3d64s2 | D. | 3p63d6 |