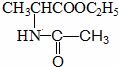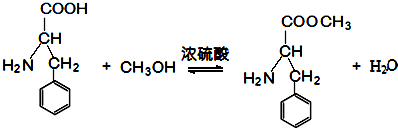题目内容
15.生活中常用一些化学知识,下列分析或结论正确的是( )| A. | 加碘食盐中添加的是碘化钾 | |
| B. | 将甲醛稀溶液喷在白菜上可以保鲜 | |
| C. | 牛奶中掺入三聚氰胺可以提高蛋白质含量 | |
| D. | 人体中维持血液的pH值稳定的主要离子是HCO3- |
分析 A.加碘食盐中添加的是碘酸钾;
B.甲醛有毒;
C.三聚氰胺有毒;
D.HCO3-既能与氢离子又能与氢氧根反应.
解答 解:A.加碘食盐中添加的是碘酸钾,不是碘化钾,故A错误;
B.甲醛有毒,不能用于食品保鲜,故B错误;
C.三聚氰胺有毒,不能用于食品添加剂,故C错误;
D.HCO3-既能与氢离子又能与氢氧根反应,可以维持人体中血液的pH值,故D正确;
故选D.
点评 本题考查了物质的用途,性质决定用途,熟悉相关物质的性质是解题关键,题目难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
12.下列关于含硫化合物的叙述不正确的是( )
| A. | SO2能与CaO反应,可用生石灰作工业废气的脱硫剂 | |
| B. | SO2能使碘的淀粉溶液由蓝色变为无色,体现出漂白性 | |
| C. | 浓硫酸和Na2SO3反应制取SO2时,浓硫酸只表现酸性 | |
| D. | 医疗上曾用硫酸钡作X射线透视肠胃的内服药剂 |
6.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜2Cu2S+Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑.对于该反应,下列说法中正确的是( )
| A. | 该反应中的氧化剂是Cu2O | |
| B. | 氧化产物和还原产物的物质的量之比为1:6 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | Cu2S在反应中仅做氧化剂 |
3.用如图所示装置,必要时可加热试管,不能达到实验目的是( )
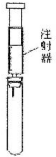

| A. | 试管中盛酚酞试液,验证氨气的水溶液呈碱性 | |
| B. | 试管中盛酸性高锰酸钾溶液,探究乙烯的还原性 | |
| C. | 试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 | |
| D. | 试管中盛氢硫酸,验证SO2的氧化性 |
10.化学与生活密切相关,下列对应关系错误的是( )
| 化学性质 | 实际应用 | |
| A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B | 铁比铜金属性强 | 刻制印刷电路板 |
| C | 次氯酸盐具有氧化性 | 作杀菌消毒剂 |
| D | 二氧化硫具有漂白性 | 漂白纸浆 |
| A. | A | B. | B | C. | C | D. | D |
20.根据下列实验,不能证明一元酸HR为弱酸的是( )
| A. | 室温下,NaR溶液的pH大于7 | |
| B. | 25℃时,0.01mol/L的HR溶液pH=2.8 | |
| C. | 加热NaR溶液时,溶液的pH变小 | |
| D. | HR溶液加入少量NaR固体,溶解后溶液的pH变大 |
7.设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| C. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA | |
| D. | 常温常压下,11.2L甲烷含有共价键数为2NA |
5.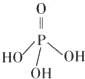 磷元素的单质及其化合物在生产和生活中有着广泛的应用.
磷元素的单质及其化合物在生产和生活中有着广泛的应用.
I.用磷矿石在高温下制备白磷(P4)的化学方程式为:2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)
(1)反应中破坏的化学键有abc.
a.离子键 b.极性共价键 c.非极性共价键
(2)白磷肯定不具有的性质是c(单项选择).
a.与强碱发生自身氧化还原反应 b.易溶于CS2
c.点燃时和氢气化合生成PH3 d.易自燃
(3)P4分子呈正四面体结构,分子中有6个P-P键,键角为600.
Ⅱ.磷酸分子结构式见图.三聚磷酸可视为三个磷酸分子之间脱去两个水分子产物,其结构式为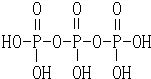 .
.
(5)根据上表数据,写出在溶液中少量H3PO4和NaF反应的离子方程式H3PO4+F-=H2PO4-+HF.
(6)NH3比PH3更易液化,原因可能是c(单项选择).
a.H-N键键能大于H-P键键能
b.NH3分子间范德华力大于PH3分子间范德华力
c.其它原因.
 磷元素的单质及其化合物在生产和生活中有着广泛的应用.
磷元素的单质及其化合物在生产和生活中有着广泛的应用.I.用磷矿石在高温下制备白磷(P4)的化学方程式为:2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)
(1)反应中破坏的化学键有abc.
a.离子键 b.极性共价键 c.非极性共价键
(2)白磷肯定不具有的性质是c(单项选择).
a.与强碱发生自身氧化还原反应 b.易溶于CS2
c.点燃时和氢气化合生成PH3 d.易自燃
(3)P4分子呈正四面体结构,分子中有6个P-P键,键角为600.
Ⅱ.磷酸分子结构式见图.三聚磷酸可视为三个磷酸分子之间脱去两个水分子产物,其结构式为
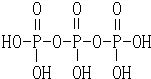 .
.| 电离常数(25℃) |
| HF:Ki=3.6×10 -4 |
| H3PO4:Ki1=7.5×10 -3, Ki2=6.2×10 -8,Ki3=2.2×10 -13 |
(6)NH3比PH3更易液化,原因可能是c(单项选择).
a.H-N键键能大于H-P键键能
b.NH3分子间范德华力大于PH3分子间范德华力
c.其它原因.
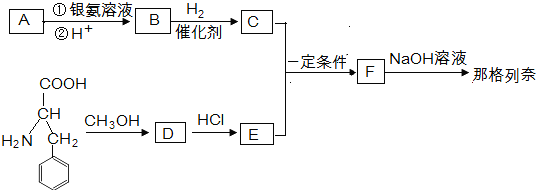
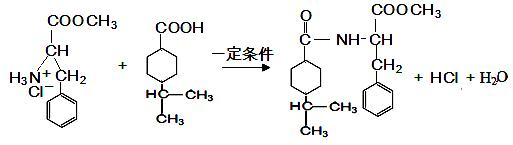
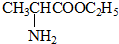 +HCl→
+HCl→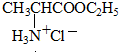
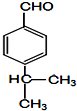
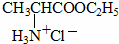 $→_{一定条件}^{CH_{3}COOH}$
$→_{一定条件}^{CH_{3}COOH}$