题目内容
6.下列各项内容,排列顺序正确是( )①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②常见离子的还原性排序:S2->I->Fe2+
③微粒半径:K+>S2->F-
④给出质子的能力:CH3COOH>C2H3OH>H2O
⑤氢化物的沸点:H2Se>H2S>H2O.
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③⑤ |
分析 ①碳酸氢钠加热易分解,碳酸钙高温分解,而碳酸钠性质稳定;
②元素的非金属性越强,对应离子还原性越弱;还原剂的还原性>还原产物的还原性,据此分析;
③离子半径先比较电子层,相同电子层再比较核电荷数,核电荷数越大半径约小;
④电离程度越小给出质子能力越弱,从电离的强弱比较:醋酸>水>乙醇;
⑤分子晶体分子量越大,熔沸点越高,注意氢键的存在能够大大提高物质的熔沸点.
解答 解:①碳酸氢钠加热易分解,碳酸钙高温分解,而碳酸钠性质稳定,所以热稳定性:Na2CO3>CaCO3>NaHCO3,故①正确;
②元素的非金属性I>S,对应离子还原性S2->I-,又碘离子能将三价铁还原成二价铁,所以还原性I->Fe2+,则还原性:S2->I->Fe2+,故②正确;
③微粒半径,K+、S2-的电子层数比F-多离子半径大,K+、S2--电子层数相同,核电荷数越大,半径越小,K+<S2-,所以离子半径大小S2->K+>F- 故③错误;
④电离程度越小给出质子能力越弱,从电离的强弱比较:醋酸>水>乙醇,故④错误;
⑤分子晶体相对分子质量越大,沸点越高,但水中存在氢键沸点反常的高,沸点大小为:H2O>H2Se>H2S,故⑤错误;
故选C.
点评 本题为综合题,考查了碳酸盐的稳定性比较、还原性比较、微粒半径大小比较、电离程度大小比较、晶体熔沸点高低比较,掌握基础是解题关键,注意晶体熔沸点规律,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.设NA表示阿伏加德罗常数.下列说法中,错误的是( )
| A. | 标准状况下,22.4 L氢气和氯气的混合气体,所含分子数为NA | |
| B. | 常温常压下,1 mol氦气含有的原子数约为NA | |
| C. | 1 mol Al3+含有核外电子数为3NA | |
| D. | t℃时,1 L pH=6的纯水中,含1×10-6NA个OH- |
17.将下列固体物质溶于水,再将其溶液加热、蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是( )
| A. | FeCl3 | B. | NaAlO2 | C. | NaHCO3 | D. | Na2SO3 |
14.下列对化学反应的认识错误的是( )
| A. | 一定会有新物质生成 | B. | 一定伴随着能量的变化 | ||
| C. | 可能会引起物质状态的变化 | D. | 有化学键破坏的一定是化学反应 |
1.由氧化亚铁、氧化铁、四氧化三铁组成的混合物ag,加入bmol/L的稀硫酸cL时固体恰好完全溶解.若将ag该混合物在足量的一氧化碳中加热充分反应,冷却后固体质量为( )
| A. | 16bc克 | B. | (a-16bc)克 | C. | (a-32bc)克 | D. | 无法计算 |
15.提纯下列物质(括号中为杂质),所用试剂和方法正确的是( )
| A. | 稀H2SO4(HCl):AgNO3溶液、过滤 | B. | KNO3(K2SO4):Ba(NO3)2溶液、过滤 | ||
| C. | Cu(CuO):盐酸、过滤 | D. | CaCO3(CaO):盐酸、过滤 |
16.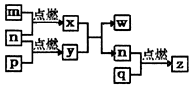 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:a<b<c<d | B. | 氢化物的沸点:b>d | ||
| C. | x的电子式为: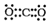 | D. | z、w含有的化学键类型完全相同 |
 含碳的化合物之间很容易发生转化.请回答下列问题:
含碳的化合物之间很容易发生转化.请回答下列问题: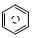 (l)的燃烧热为 3267.5kJ•mol-1,
(l)的燃烧热为 3267.5kJ•mol-1,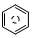 (l)+6O 2(g)═6CO2 (g)+3H2 (g)
(l)+6O 2(g)═6CO2 (g)+3H2 (g)