题目内容
3.下列关于离子共存或离子反应的说法正确的是( )| A. | 某无色溶液中可能大量存在:H+、Cl-、MnO${\;}_{4}^{-}$ | |
| B. | 室温下由水电离的 c(OH-)=1×10-12mol•L-1的溶液中能大量共存:K+、Na+、Cl-、HCO3- | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2 Br2+6 Cl- | |
| D. | 稀硫酸和Ba(OH)2溶液反应:H++SO${\;}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O |
分析 A.高锰酸根离子为有色离子,酸性条件下高锰酸根离子能够氧化氯离子;
B.该溶液呈酸性或碱性,碳酸氢根离子与氢离子、氢氧根离子反应;
C.氯气足量,溴离子和亚铁离子都完全反应;
D.氢离子、氢氧根离子的计量数错误.
解答 解:A.MnO4-为有色离子,MnO4-、Cl-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.室温下由水电离的c(OH-)=1×10-12mol•L-1的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.向FeBr2溶液中通入足量氯气,二者发生氧化还原反应,反应的离子方程式为:2Fe2++4Br-+3Cl2═2 Fe3++2 Br2+6 Cl-,故C正确;
D.稀硫酸和Ba(OH)2溶液反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查离子共存、离子方程式的正误判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子共存的条件,试题培养了学生的灵活应用能力.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
11.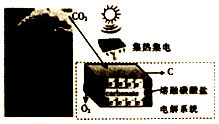 最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )
最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )
 最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )
最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )| A. | 图中能量化方式只有一种 | |
| B. | 阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑ | |
| C. | 若反应中转移1mole-,则理论上消耗CO32-0.5mol | |
| D. | 当生成12g碳材料时,可收集到22.4L O2 |
18.化学与生活息息相关,下列说法不正确的是( )
| A. | 建筑要使用大量的沙,常使用内陆河的河沙及海洋的海沙 | |
| B. | 含次氯酸盐的漂白粉与含盐酸的洁厕灵混合使用会产生有毒气体 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用和原理不相同 | |
| D. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 |
8.下列说法正确的是 ( )
| A. | 明矾净水过程中不涉及化学变化 | |
| B. | 由同种元素组成的物质不一定是纯净物 | |
| C. | 风化、石油分馏和碘的升华都是物理变化 | |
| D. | 在化学反应中,反应前后原子种类、数目和质量一定不变 |
15.将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个反应:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+,Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,有关说法正确的是( )
| A. | 还原性:SO2>Fe2+>Cr3+ | B. | 氧化性:Cr2O72->SO2>Fe3+ | ||
| C. | Cr2O72-能将Na2SO3氧化成Na2SO4 | D. | 两个反应中Fe2(SO4)3均作还原剂 |
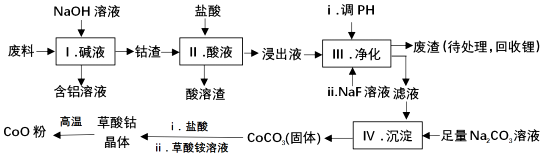
12.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含Al、Li、Co2O3和Fe2O3等物质)
已知:①物质溶解性:LiF难溶于水;LiCO3微溶于水;CoCO3难溶于水
②部分金属离子形成氢氧化物沉淀的pH见表一.
表一:
请回答:
(1)I中得到含铝溶液的反应离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)I中得到钴渣的实验操作是过滤(填操作名称).
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(4)步骤Ⅲ中调节溶液的pH时,pH的范围是3.2≤PH<7.15
(5)废渣中的主要成分有Fe(OH)3,LiF.步骤Ⅲ中加入NaF溶液,对步骤Ⅳ所起的作用是降低溶液中Li+的浓度,避免步骤Ⅳ形成Li2CO3的沉淀.
(6)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表二.已知[M(CoC2O4•2H2O)]=183g/mol
表二:
①加热到210℃时,固体物质的化学式为:CoC2O4
②经测定,加热到210~310℃过程中生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2$\frac{\underline{\;210~310℃\;}}{\;}$Co3O4+6CO2.

已知:①物质溶解性:LiF难溶于水;LiCO3微溶于水;CoCO3难溶于水
②部分金属离子形成氢氧化物沉淀的pH见表一.
表一:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)I中得到含铝溶液的反应离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)I中得到钴渣的实验操作是过滤(填操作名称).
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(4)步骤Ⅲ中调节溶液的pH时,pH的范围是3.2≤PH<7.15
(5)废渣中的主要成分有Fe(OH)3,LiF.步骤Ⅲ中加入NaF溶液,对步骤Ⅳ所起的作用是降低溶液中Li+的浓度,避免步骤Ⅳ形成Li2CO3的沉淀.
(6)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表二.已知[M(CoC2O4•2H2O)]=183g/mol
表二:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
②经测定,加热到210~310℃过程中生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2$\frac{\underline{\;210~310℃\;}}{\;}$Co3O4+6CO2.
13.Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | Na2S有强还原性 | 用于除去废水中的Cu2+和Hg2+ |
| B | 浓H2SO4有强氧化性 | 浓H2SO4可用于干燥SO2 |
| C | NaHCO3溶于水完全电离 | NaHCO3是强电解质 |
| D | Cl2具有酸性 | Cl2可与石灰乳或烧碱反应制备含氯消毒剂 |
| A. | A | B. | B | C. | C | D. | D |