题目内容
16.如图是煤化工产业链的一部分,试运用所学知识,解决下列问题: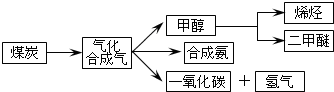
I.已知该产业链中某反应的平衡表达式为:K=$\frac{{c({H_2})•c({CO})}}{{c({H_2}O)}}$,它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g);
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1,830℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=5.4mol/L.
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
②平衡时二甲醚的物质的量浓度是1.6mol/L.
分析 I.化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,根据元素守恒知,反应物中还含有固体碳;
II(1)将方程式①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),焓变进行相应的改变;降低温度平衡向放热方向移动;
(2)该反应中CO(g)+2H2(g)?CH3OH(g)
开始(mol/L)1 2.4 0
反应(mol/L)1×50% 1×50%×2 1×50%
平衡(mol/L)0.5 1.4 0.5
化学平衡常数K=$\frac{0.5}{0.5×1.{4}^{2}}$=$\frac{1}{1.{4}^{2}}$,
温度不变化学平衡常数K不变,据此计算a值;
(3)①先计算浓度商,根据浓度商与化学平衡常数相对大小确定反应方向,从而确定正逆反应速率相对大小;
②根据化学平衡常数计算平衡时二甲醚的物质的量浓度.
解答 解:Ⅰ.化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,根据元素守恒知,反应物中还含有固体碳,由化学平衡常数表达式知,该反应方程式为C(s)+H2O(g)?CO(g)+H2(g),
故答案为:C(s)+H2O(g)?CO(g)+H2(g);
Ⅱ.(1)①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
将方程式①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),△H=2(-90.7kJ•mol-1
)+(-23.5kJ•mol-1)+(-41.2kJ•mol-1)=-247kJ•mol-1,
③的正反应是放热反应,降低温度平衡正向移动,化学平衡常数增大,所以在催化反应室中反应③的K>1.0,
故答案为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1;>;
(2)该反应中CO(g)+2H2(g)?CH3OH(g)
开始(mol/L)1 2.4 0
反应(mol/L)1×50% 1×50%×2 1×50%
平衡(mol/L)0.5 1.4 0.5
化学平衡常数K=$\frac{0.5}{0.5×1.{4}^{2}}$=$\frac{1}{1.{4}^{2}}$,
温度不变化学平衡常数K不变,
该反应中CO(g)+2H2(g)?CH3OH(g)
开始(mol/L)4 a 0
反应(mol/L)2 4 2
平衡(mol/L)2 a-4 2
化学平衡常数K=$\frac{2}{2×(a-4)^{2}}$=$\frac{1}{1.{4}^{2}}$,
a=5.4,
故答案为:5.4;
(3)①浓度商=$\frac{1.2{4}^{2}}{0.{8}^{2}}$=2.4<400,平衡正向移动,则v正 大于 v逆,
故答案为:大于;
②设达到平衡时二甲醚反应的物质的量浓度为xmol/L,
该反应2CH3OH(g)?CH3OCH3(g)+H2O
开始(mol/L)0.8 1.24 1.24
反应(mol/L)2x x x
平衡(mol/L)0.8-2x 1.24+x 1.24+x
化学平衡常数K=$\frac{(1.24+x)^{2}}{(0.8-x)^{2}}$=400
x=0.36,
则平衡时二甲醚的物质的量浓度=(1.24+0.36)mol/L=1.6mol/L,
故答案为:1.6mol/L.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,灵活运用三段式是解本题关键,会利用化学平衡常数与浓度商的关系确定反应方向,题目难度不大.

(2)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
①该反应的△H<0 (填“>”“<”或“=”),1150℃时,当CO、CO2浓度均为1.0mol/L时,化学平衡向(填“正向”、“逆向”或“不移动”)正向移动.
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1•min-1;CO的转化率=60%.
③欲提高$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂.
 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式K=$\frac{[CH{\;}_{3}OCH{\;}_{3}]•[H{\;}_{2}O]{\;}^{3}}{[CO{\;}_{2}]{\;}^{2}•[H{\;}_{2}]{\;}^{6}}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是BD.
A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3
D.容器内压强保持不变
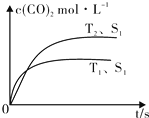
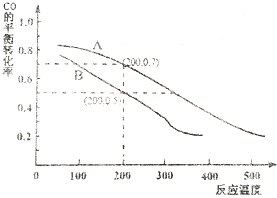
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g) $\stackrel{催化剂}{?}$2CO2 (g)+N2 (g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
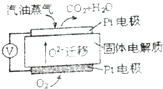
 化工工业中常用乙苯脱氢的方法制备苯乙烯.
化工工业中常用乙苯脱氢的方法制备苯乙烯.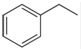 (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol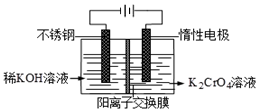 已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.
已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.