题目内容
11.(1)25℃时,一定浓度的K2Cr2O7溶液中存在下列平衡:Cr2O72-(橙色)+H2O═2CrO42-(黄色)+2H+ K=8.3×10-15,则该反应的平衡常数表达式K=$\frac{{c}^{2}({H}^{+})•{c}^{2}(Cr{{O}_{4}}^{2-})}{c(C{r}_{2}{{O}_{7}}^{2-})}$,取少量上述溶液两等份,分别滴加浓硫酸和浓烧碱溶液,出现的现象依次是显橙红色,显黄色.(2)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
①该反应的△H<0 (填“>”“<”或“=”),1150℃时,当CO、CO2浓度均为1.0mol/L时,化学平衡向(填“正向”、“逆向”或“不移动”)正向移动.
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1•min-1;CO的转化率=60%.
③欲提高$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂.
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,水不需要写出,据此书写;加入NaOH,中和氢离子,氢离子浓度降低,平衡向右移动;加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大;
(2)①由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应;计算出浓度商,根据平衡常数判断平衡移动方向;
②设平衡时CO的物质的量浓度变化为c,利用三段式表示出平衡时CO、CO2的物质的量浓度,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算c,利用v=$\frac{△c}{△t}$计算v(CO),再利用转化率定义计算CO的转化率;
③提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析.
解答 解:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,水不需要写出,即该反应的平衡常数为:K=$\frac{{c}^{2}({H}^{+})•{c}^{2}(Cr{{O}_{4}}^{2-})}{c(C{r}_{2}{{O}_{7}}^{2-})}$;
加入NaOH,中和氢离子,氢离子浓度降低,平衡向右移动,显黄色;加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,显橙红色,
故答案为:$\frac{{c}^{2}({H}^{+})•{c}^{2}(Cr{{O}_{4}}^{2-})}{c(C{r}_{2}{{O}_{7}}^{2-})}$;显橙红色,显黄色;
(2)①由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0;
1150℃时,平衡常数K=3.7,当CO、CO2浓度均为1.0mol/L时,其浓度商Qc=$\frac{c(C{O}_{2})}{c(CO)}$=1<3.7,说明生成物浓度较小,平衡正向着正向移动,
故答案为:<;正向;
②设平衡时CO的物质的量浓度变化为cmol/L,则
则:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
开始(mol/L):0.1 0.1
变化(mol/L):c c
平衡(mol/L):0.1-c 0.1+c
所以$\frac{0.1+c}{0.1-c}$=4,解得:c=0.06,
所以v(CO2)=$\frac{0.06mol/L}{10min}$=0.006 mol•L-1•min-1;
CO的平衡转化率为:$\frac{0.06mol/L}{0.1mol/L}$×100%=60%,
故答案为:0.006 mol•L-1•min-1;60%;
③A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故C正确;
D.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故D错误;
E.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故E错误;
F.加入合适的催化剂,平衡不移动,故F错误;
故答案为:C.
点评 本题考查较为综合,涉及化学平衡常数、反应速率、转化率、化学平衡及其影响等知识,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握化学平衡常数、化学反应速率的概念及表达式,试题培养了学生的化学计算能力.

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A. | SO2的平衡转化率:α1>α2=α3 | B. | SO3的物质的量浓度:c(甲)=c(丁)<c(丙) | ||
| C. | 甲、乙中的平衡常数:K(甲)=K(乙)=400 | D. | 丙、丁中的平衡常数:K(丙)<K(丁) |
| A. |  | B. |  | C. |  | D. |  |
 已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )
已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点时c(Ag+)=c(I-) | |
| D. | 该温度下,AgCl和AgBr饱和溶液中:c(Cl-)<c(Br-) |
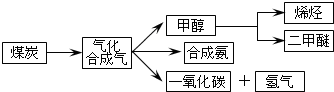
I.已知该产业链中某反应的平衡表达式为:K=$\frac{{c({H_2})•c({CO})}}{{c({H_2}O)}}$,它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g);
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1,830℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=5.4mol/L.
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
②平衡时二甲醚的物质的量浓度是1.6mol/L.
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4.
②已知反应2HI(g)?H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为299kJ.
③Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1.