题目内容
甲醇是未来重要的绿色能源之一.以CH4和H2O为原料,通过下列反应来制备甲醇.
Ⅰ、CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)═CH3OH(g)△H=-129.0KJ/mol
(1)CH4(g)与 H2O(g)反应成CH3OH(g)和H2(g)的热化学方程式为 .
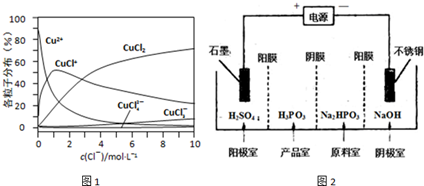
(2)将1.0mol CH4和2.0mol H2O(g)通入容积为2L的密闭容器中,在一定条件下发生反应I,测得在一定压强下平衡时CH4的转化率与温度的关系如图1.
①假设100℃时反应I达到平衡所需的时间为5min,则用H2表示这段时间该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .若保持温度和容器的容积不变,5min时再向容器中充入H2O(g)和CO各0.2mol,平衡将 移动(填“正向”、“逆向”或“不”).
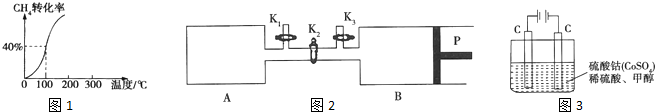
(3)如图2,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO和3mol H2,在一定条件下发生反应Ⅱ,关闭K1、K3,反应起始时A、B的体积相同,均为a L.
①反应达到平衡后,A内压强为起始压强的
,则平衡时A容器中H2的体积分数为 .
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6a L,则打开K2之前,B容器的体积为 L.
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将CO2+氧化成CO3+,然后以CO3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图3装置模拟上述过程:
①写出阳极电极反应式 ;
②写出除去甲醇的离子方程式 .
Ⅰ、CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)═CH3OH(g)△H=-129.0KJ/mol
(1)CH4(g)与 H2O(g)反应成CH3OH(g)和H2(g)的热化学方程式为
(2)将1.0mol CH4和2.0mol H2O(g)通入容积为2L的密闭容器中,在一定条件下发生反应I,测得在一定压强下平衡时CH4的转化率与温度的关系如图1.

①假设100℃时反应I达到平衡所需的时间为5min,则用H2表示这段时间该反应的平均反应速率为
②100℃时反应I的平衡常数为
(3)如图2,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO和3mol H2,在一定条件下发生反应Ⅱ,关闭K1、K3,反应起始时A、B的体积相同,均为a L.
①反应达到平衡后,A内压强为起始压强的
| 3 |
| 5 |
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6a L,则打开K2之前,B容器的体积为
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将CO2+氧化成CO3+,然后以CO3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图3装置模拟上述过程:
①写出阳极电极反应式
②写出除去甲醇的离子方程式
考点:热化学方程式,原电池和电解池的工作原理,化学平衡建立的过程,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)根据盖斯定律书写热化学方程式;
(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量,
①根据c=
计算v(H2)
②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;比较Qc和K的大小解答;
(3)在AB中发生反应CO(g)+2H2(g)═CH3OH(g),依据三段式法解答,注意相同体积时,气体的压强之比等于气体的物质的量之比,压强相等时,气体的体积之比等于物质的量之比;
(4))①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量,
①根据c=
| ||
| △t |
②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;比较Qc和K的大小解答;
(3)在AB中发生反应CO(g)+2H2(g)═CH3OH(g),依据三段式法解答,注意相同体积时,气体的压强之比等于气体的物质的量之比,压强相等时,气体的体积之比等于物质的量之比;
(4))①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
解答:
解:(1)I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77.0kJ?mol-1
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77.0kJ?mol-1;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为2L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为40%,故参加反应的甲烷为1mol×40%=0.4mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.4 0.4 0.4 1.2
平衡量(mol):0.6 1.6 0.4 1.2
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=
=0.12 mol?L-1?min-1,
故答案为:0.12 mol?L-1?min-1;
②100℃时反应I的平衡浓度为c(CH4)=0.30mol/L,c(H2O)=0.8mol/L,c(CO)=0.2mol/L,c(H2)=0.6mol/L,
平衡常数K=
=0.18mol2?L-2,
平衡后再向容器中充入H2O(g)和CO各0.2mol,则c(CH4)=0.30mol/L,c(H2O)=0.9mol/L,c(CO)=0.3mol/L,c(H2)=0.6mol/L,Qc=
=0.24(mol/L)2>K=0.18mol2?L-2,平衡逆向移动,
故答案为:0.18mol2?L-2;逆向;
(3)①A中 CO(g)+2H2(g)═CH3OH(g)
反应前(mol)2 3 0
反应了(mol)x 2x x
平衡后(mol)2-x 3-2x x
体积不变时,气体的压强之比等于气体的物质的量之比,则有(2-x+3-2x+x):(2+3)=3:5
解得:x=1,平衡时氢气的体积分数为:
=
,故答案为:
;
②打开K2,AB都是恒压环境,AB的体积共缩小了0.4aL,A与B体积相等,则A与B各缩小了0.2aL,则打开K2之前,B容器的体积为0.8aL,故答案为:0.8aL;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77.0kJ?mol-1
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77.0kJ?mol-1;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为2L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为40%,故参加反应的甲烷为1mol×40%=0.4mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.4 0.4 0.4 1.2
平衡量(mol):0.6 1.6 0.4 1.2
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=
| ||
| 5min |
故答案为:0.12 mol?L-1?min-1;
②100℃时反应I的平衡浓度为c(CH4)=0.30mol/L,c(H2O)=0.8mol/L,c(CO)=0.2mol/L,c(H2)=0.6mol/L,
平衡常数K=
| 0.6mol?L-13×0.2mol?L-1 |
| 0.3mol?L-1×0.8mol?L-1 |
平衡后再向容器中充入H2O(g)和CO各0.2mol,则c(CH4)=0.30mol/L,c(H2O)=0.9mol/L,c(CO)=0.3mol/L,c(H2)=0.6mol/L,Qc=
| 0.6mol?L-13×0.3mol?L-1 |
| 0.9mol?L-1×0.3mol?L-1 |
故答案为:0.18mol2?L-2;逆向;
(3)①A中 CO(g)+2H2(g)═CH3OH(g)
反应前(mol)2 3 0
反应了(mol)x 2x x
平衡后(mol)2-x 3-2x x
体积不变时,气体的压强之比等于气体的物质的量之比,则有(2-x+3-2x+x):(2+3)=3:5
解得:x=1,平衡时氢气的体积分数为:
| 1mol |
| 1mol+1mol+1mol |
| 1 |
| 3 |
| 1 |
| 3 |
②打开K2,AB都是恒压环境,AB的体积共缩小了0.4aL,A与B体积相等,则A与B各缩小了0.2aL,则打开K2之前,B容器的体积为0.8aL,故答案为:0.8aL;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
点评:本题考查了盖斯定律的应用、化学反应速率的求算、化学平衡常数的求算及与Qc的关系、恒压恒容容器中反应情况比较、原电池原理分析和电极反应书写方法,题目难度较大,注意认真分析.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
第三周期主族元素中,原子半径最大的是( )
| A、Na | B、Si | C、S | D、Cl |
能大量共存且溶液为无色透明的离子组是( )
| A、Ag+,K+,NO3-,Cl- |
| B、Na+,H+,NO3-,SO42- |
| C、K+,Ca2+,NO3-,CO32- |
| D、Cu2+,Ba2+,Cl-,SO42- |
 几种含硅元素的物质之间的相互转化关系如图所示.
几种含硅元素的物质之间的相互转化关系如图所示. 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题: