题目内容
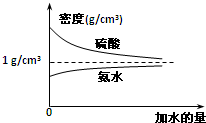 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶液 | 溶质的物质的量浓度 | 溶液的密度/g?cm-3 |
| 硫酸 | 4mol?L-1 | ρ1 |
| 2mol?L-1 | ρ2 | |
| 氨水 | 4mol?L-1 | ρ3 |
| 2mol?L-1 | ρ4 |
(2)表中2mol?L-1氨水的质量分数为:
(3)将4mol?L-1的氨水与2mol?L-1的氨水等质量混合,所得氨水的物质的量浓度是
A.>3mol?L-1 B.=3mol?L-1 C.<3mol?L-1 D.无法判断
(4)将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是
A.>15% B.=15% C.<15% D.无法判断
(5)100g浓度为4mol?L-1的硫酸溶液与
考点:弱电解质在水溶液中的电离平衡,物质的量浓度的相关计算,溶液中溶质的质量分数及相关计算
专题:计算题,电离平衡与溶液的pH专题
分析:(1)硫酸的密度大于水的密度,浓度越大,密度越大,氨水的密度小于水的密度,浓度越大,密度越小;
(2)根据c=
进行公式变形计算即可;
(3)由图可知,氨水的浓度越大密度越小;
(4)密度大于水的溶液等体积混合后,质量分数比原来质量分数和的一半要大;
(5)根据溶液稀释前后溶质的物质的量保持不变来回答.
(2)根据c=
| 1000ρw |
| M |
(3)由图可知,氨水的浓度越大密度越小;
(4)密度大于水的溶液等体积混合后,质量分数比原来质量分数和的一半要大;
(5)根据溶液稀释前后溶质的物质的量保持不变来回答.
解答:
解:(1)硫酸的密度大于水的密度,氨水的密度小于水的密度,所以ρ1、ρ2>ρ4、ρ3,硫酸的密度大于水的密度,浓度越大,密度越大,ρ1>ρ2氨水的密度小于水的密度,浓度越大,密度越小,ρ4>ρ3,故答案为:ρ1>ρ2>ρ4>ρ3;
(2)表中2mol?L-1氨水的密度是ρ4,根据公式c=
得出质量分数为:w=
%,故答案为:
%;
(3)由图可知,氨水的浓度越大密度越小,将4mol?L-1的氨水与2mol?L-1的氨水等质量混合,所得氨水的物质的量浓度要比3mol?L-1大,故答案为:A;
(4)硫酸的密度大于水的密度,将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数>
,即混合后质量分数大于15%,故答案为:A;
(5)100g浓度为4mol?L-1的硫酸溶液中溶质的物质的量是
=
,设加入水的体积是VmL,能使硫酸的物质的量浓度减小到2mol?L-1,则2(
)=
,解得V=
mL,故答案为:
.
(2)表中2mol?L-1氨水的密度是ρ4,根据公式c=
| 1000ρw |
| M |
| 3.4 |
| ρ4 |
| 3.4 |
| ρ4 |
(3)由图可知,氨水的浓度越大密度越小,将4mol?L-1的氨水与2mol?L-1的氨水等质量混合,所得氨水的物质的量浓度要比3mol?L-1大,故答案为:A;
(4)硫酸的密度大于水的密度,将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数>
| 20%+10% |
| 2 |
(5)100g浓度为4mol?L-1的硫酸溶液中溶质的物质的量是
| ||
| 98 |
| 2 |
| 5ρ1 |
| 100+V |
| 1000ρ2 |
| 2 |
| 5ρ1 |
| 200ρ2-100ρ1 |
| ρ1 |
| 200ρ2-100ρ1 |
| ρ1 |
点评:本题考查物质的量浓度的有关计算,难度中等.注意氨水的浓度越大密度越小.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、H与O可形成既含极性共价键又含非极性共价键的化合物 |
| B、非金属元素组成的化合物中只含共价键 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、Na2O与Na2O2中阴阳离子个数比不相等 |
下列仪器:①大试管 ②烧杯 ③圆底烧瓶 ④蒸发皿 ⑤坩埚 ⑥量筒 ⑦容量瓶.可用酒精灯加热,但需要垫上石棉网的是( )
| A、②和③ | B、①②③ |
| C、②④⑤⑦ | D、②③⑤⑥⑦ |