题目内容
6.5g锌粉与足量盐酸反应产生氢气,已知反应后溶液的体积为500ml.
(1)写出锌与盐酸反应的离子方程式.
(2)在标准状况下,上述反应生成的氢气的体积为多少升?
(3)求反应后溶液中ZnCl2的物质的量浓度?
(1)写出锌与盐酸反应的离子方程式.
(2)在标准状况下,上述反应生成的氢气的体积为多少升?
(3)求反应后溶液中ZnCl2的物质的量浓度?
考点:化学方程式的有关计算
专题:计算题
分析:(1)锌和盐酸反应的实质是锌与氢离子反应生成Zn2+和氢气;
(2)由离子方程式可知氢气的物质的量与锌的物质的量相等,根据
=n=
计算;
(3)根据Zn元素守恒可知n(ZnCl2)=n(Zn)=0.1mol,带入c=
计算浓度.
(2)由离子方程式可知氢气的物质的量与锌的物质的量相等,根据
| m |
| M |
| V |
| Vm |
(3)根据Zn元素守恒可知n(ZnCl2)=n(Zn)=0.1mol,带入c=
| n |
| V |
解答:
解:(1)锌和盐酸反应的实质是锌与氢离子反应生成Zn2+和氢气,锌与盐酸反应的离子方程式:Zn+2H+=Zn2++H2↑,
答:锌与盐酸反应的离子方程式为Zn+2H+=Zn2++H2↑;
(2)由Zn+2H+=Zn2++H2↑可知氢气的物质的量与锌的物质的量相等,n(H2)=n(Zn)=
=0.1mol,则标准状况下V(H2)=0.1mol×22.4L/mol=2.24L,
答:在标准状况下,上述反应生成的氢气的体积为2.24L;
(3)根据Zn元素守恒可知n(ZnCl2)=n(Zn)=0.1mol,则反应后溶液中ZnCl2的物质的量浓度c=
=0.2mol/L,
答:反应后溶液中ZnCl2的物质的量浓度是0.2mol/L.
答:锌与盐酸反应的离子方程式为Zn+2H+=Zn2++H2↑;
(2)由Zn+2H+=Zn2++H2↑可知氢气的物质的量与锌的物质的量相等,n(H2)=n(Zn)=
| 6.5g |
| 65g/mol |
答:在标准状况下,上述反应生成的氢气的体积为2.24L;
(3)根据Zn元素守恒可知n(ZnCl2)=n(Zn)=0.1mol,则反应后溶液中ZnCl2的物质的量浓度c=
| 0.1mol |
| 0.5L |
答:反应后溶液中ZnCl2的物质的量浓度是0.2mol/L.
点评:本题考查根据方程式进行的计算,难度不大,侧重对基础知识的巩固,注意基础知识、基本公式的理解掌握.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1mo1的Fe在1mo1Cl2中充分燃烧,转移电子数为3NA |
| B、7.2g CaO2中的阴离子含有的电子数为1.0NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
| D、标准状况下,22.4L盐酸含有2NA个离子 |
下列物质分类正确的是( )
| A、福尔马林、水玻璃、氨水均为混合物 |
| B、稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C、烧碱、冰醋酸、四氯化碳均为电解质 |
| D、SO2、SiO2、CO均为酸性氧化物 |
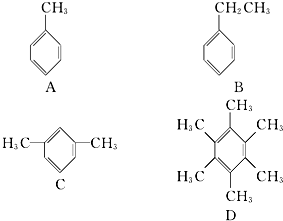
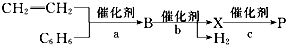

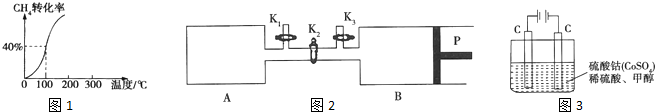
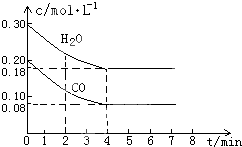 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示反应物的转化率越
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示反应物的转化率越