题目内容
光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
(1)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2 和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1,则1mol CH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g)═Cl2(g)+CO(g)△H=+108kJ?mol-1.反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
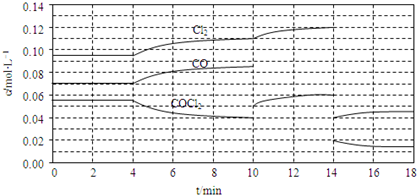
①比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6) v(15-16)(填“<”、“>”或“=”),原因是 .
③计算反应在第8min时的平衡常数K= ;(列出计算过程,结果保留两位小数)
(1)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2 和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1,则1mol CH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g)═Cl2(g)+CO(g)△H=+108kJ?mol-1.反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):

①比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)
②比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6)
③计算反应在第8min时的平衡常数K=
考点:物质的量或浓度随时间的变化曲线,热化学方程式,化学平衡常数的含义,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)氯仿(CHCl3)与双氧水直接反应制备光气( COCl2),根据化合价升降相等配平,然后写出反应的化学方程式;
(2)据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式,利用盖斯定律书写该反应的热化学方程式;
(3)①由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动;
②在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小;
③由图可知8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
.
(2)据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式,利用盖斯定律书写该反应的热化学方程式;
(3)①由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动;
②在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小;
③由图可知8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
| c(CO)?c(Cl2) |
| c(COCl2) |
解答:
解:(1)CHCl3中C元素的化合价为+2,反应产物COCl2中碳元素的化合价为+4,化合价升高了2价;双氧水中氧元素化合价为-1价,1mol双氧水反应化合价降低2价,所以CHCl3与双氧水的化学计量数都是1,然后根据观察法配平后的化学方程式为CHCl3+H2O2=HCl+H2O+COCl2,
故答案为:CHCl3+H2O2=HCl+H2O+COCl2;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol -1,
故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol -1;
(3)①由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
故答案为:<;
②在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),
故答案为:>;在相同温度时,该反应的反应物的浓度越高,反应速率越大;
③由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
=
=0.23,
故答案为:0.23.
故答案为:CHCl3+H2O2=HCl+H2O+COCl2;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol -1,
故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol -1;
(3)①由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
故答案为:<;
②在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),
故答案为:>;在相同温度时,该反应的反应物的浓度越高,反应速率越大;
③由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
| c(CO)?c(Cl2) |
| c(COCl2) |
| 0.085×0.11 |
| 0.04 |
故答案为:0.23.
点评:本题考查较综合,涉及根据斯定律书写热化学方程式、影响化学反应速率的因素、化学平衡常数的计算等知识,题目难度中等,难点是化学平衡常数的有关计算,理解图象中曲线变化趋势及曲线变化可能改变的条件是解本题关键,再结合平衡常数公式进行计算.

练习册系列答案
相关题目
下列说法中,正确的是( )
| A、CO2的摩尔质量为44 g |
| B、1 mol N2的质量是14 g |
| C、等质量的水与质量分数98%L的硫酸混合所得溶液的质量分数大于49% |
| D、标准状况下,1 mol CO2所占的体积约是22.4 L |
 某有机物A的分子式为C10H20O2,已知A~E有如图转化关系.则A 的结构可能有( )
某有机物A的分子式为C10H20O2,已知A~E有如图转化关系.则A 的结构可能有( )| A、16种 | B、2种 | C、8种 | D、4种 |
下列说法正确的是( )
| A、常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大 |
| B、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
| C、BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 |
| D、为准确测定盐酸与氢氧化钠溶液反应的中和热,所用酸和碱的物质的量应相等 |
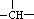 ,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构) A~G是几种烃的分子球棍模型,据此回答下列问题:
A~G是几种烃的分子球棍模型,据此回答下列问题: 的名称是:
的名称是: