题目内容
已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O?HCl+HClO;HClO?H++ClO-,达到平衡后:
(1)CO2溶于水的电离方程式为:
(2)向氯水中加入NaOH固体时,平衡向 移动,c(H+) ,c(ClO-) :
(3)要使HClO的浓度增大,可加入下列物质(填代号) .
A.SO2 B.NaHCO3 C.HCl
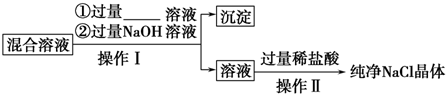
(4)由此说明在实验室里可用排饱和食盐水收集Cl2的理由是 .
(1)CO2溶于水的电离方程式为:
(2)向氯水中加入NaOH固体时,平衡向
(3)要使HClO的浓度增大,可加入下列物质(填代号)
A.SO2 B.NaHCO3 C.HCl
(4)由此说明在实验室里可用排饱和食盐水收集Cl2的理由是
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)CO2溶于水生成碳酸,碳酸为二元弱酸,存在两步电离;
(2)根据化学平衡移动分析;
(3)要使HClO的浓度增大,则氯气与水的反应向正方向移动,而且不消耗HClO;
(4)根据影响平衡的因素分析.
(2)根据化学平衡移动分析;
(3)要使HClO的浓度增大,则氯气与水的反应向正方向移动,而且不消耗HClO;
(4)根据影响平衡的因素分析.
解答:
解:(1)CO2溶于水生成碳酸,碳酸为二元弱酸,存在两步电离,存在电离平衡,电离方程式为:H2CO3?H++HCO3-、HCO3-?H++CO32-,
故答案为:H2CO3?H++HCO3-、HCO3-?H++CO32-;
(2)氯水中存在下列平衡:Cl2+H2O?HCl+HClO;HClO?H++ClO-,向氯水中加入NaOH固体时,氢离子浓度减小,平衡向正方向移动,氢离子浓度减小,ClO-浓度增大;
故答案为:正向;减小;增大;
(3)要使HClO的浓度增大,则氯气与水的反应向正方向移动,而且不消耗HClO,
A.加入SO2会消耗氯气,使平衡逆移,则HClO的浓度减小,故A错误;
B.加入NaHCO3会消耗氢离子,使平衡正移,则HClO的浓度增大,故B正确;
C.加入HCl,氢离子浓度增大,使平衡逆移,则HClO的浓度减小,故C错误;
故答案为:B;
(4)饱和食盐水中氯离子浓度较大,使Cl2+H2O?HCl+HClO的平衡逆向进行,减小了氯气的溶解,
故答案为:氯离子浓度大使平衡逆向移动,减小氯气的溶解.
故答案为:H2CO3?H++HCO3-、HCO3-?H++CO32-;
(2)氯水中存在下列平衡:Cl2+H2O?HCl+HClO;HClO?H++ClO-,向氯水中加入NaOH固体时,氢离子浓度减小,平衡向正方向移动,氢离子浓度减小,ClO-浓度增大;
故答案为:正向;减小;增大;
(3)要使HClO的浓度增大,则氯气与水的反应向正方向移动,而且不消耗HClO,
A.加入SO2会消耗氯气,使平衡逆移,则HClO的浓度减小,故A错误;
B.加入NaHCO3会消耗氢离子,使平衡正移,则HClO的浓度增大,故B正确;
C.加入HCl,氢离子浓度增大,使平衡逆移,则HClO的浓度减小,故C错误;
故答案为:B;
(4)饱和食盐水中氯离子浓度较大,使Cl2+H2O?HCl+HClO的平衡逆向进行,减小了氯气的溶解,
故答案为:氯离子浓度大使平衡逆向移动,减小氯气的溶解.
点评:本题考查了弱电解质的电离平衡、及平衡移动原理的应用,侧重于反应原理的应用的考查,题目难度中等.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
在常温下,发生下列几种反应:①16H++10Z一+2XO4一=2X2++5Z2+8H2O ②2A2++B2=2A3++2B一 ③2B一+Z2=B2+2Z根据上述反应,判断下列结论中错误的是( )
| A、氧化性强弱的顺序为:XO4一>Z2>B2>A3+ |
| B、Z2在①、③反应中为还原剂 |
| C、溶液中可发生:Z2+2A2+=2A3++2Z一 |
| D、X2十是XO4一的氧化产物 |
化学在工业生产和日常生活中都有着重要的应用,下列说法正确的是( )
| A、活性炭、SO2、氯水都会因发生氧化还原反应而使品红溶液褪色 |
| B、Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| C、常温下,浓硫酸、浓硝酸与铝均能发生钝化,均能用铝罐储运 |
| D、水玻璃,从分类法的角度,可看作纯净物,可用于木材等的防火剂 |
生活中应注重食谱营养搭配的均衡性,下列午餐食谱中最有利于学生身体发育的是( )
| A、馒头、榨菜、黄瓜、香蕉 |
| B、面条、醋溜土豆丝、素炒白菜 |
| C、米饭、糖醋排骨、粉蒸肉、清蒸鲈鱼 |
| D、米饭、红烧鲫鱼、西红柿蛋汤、蒜蓉生菜、苹果 |
 Ⅰ.CN-能与Ni2+形成[Ni(CN)4]2-配离子
Ⅰ.CN-能与Ni2+形成[Ni(CN)4]2-配离子 化学能转变成热能、化学能转变成电能是能量转化的重要形式.
化学能转变成热能、化学能转变成电能是能量转化的重要形式.