题目内容
下列说法正确的是( )
| A、常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大 |
| B、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
| C、BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 |
| D、为准确测定盐酸与氢氧化钠溶液反应的中和热,所用酸和碱的物质的量应相等 |
考点:弱电解质在水溶液中的电离平衡,反应热和焓变,难溶电解质的溶解平衡及沉淀转化的本质,中和热的测定
专题:基本概念与基本理论
分析:A.酸或碱抑制水电离,含有弱离子的盐促进水电离;
B.Qc>Ksp时,生成沉淀;
C.△G=△H-T△S>0时该反应不能自发进行,该反应中△S>0;
D.盐酸具有挥发性.
B.Qc>Ksp时,生成沉淀;
C.△G=△H-T△S>0时该反应不能自发进行,该反应中△S>0;
D.盐酸具有挥发性.
解答:
解:A.酸或碱抑制水电离,含有弱离子的盐促进水电离,所以常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者小,故A错误;
B.将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化BaCO3,是Qc(BaCO3)>Ksp(BaCO3)生成沉淀,所以可将BaSO4转化为BaCO3,故B正确;
C.△G=△H-T△S>0时该反应不能自发进行,该反应中△S>0,则△H>0,故C错误;
D.中和反应热的测定应使盐酸充分反应,需加入稍过量的NaOH溶液减少盐酸的挥发,减少误差,故D错误;
故选B.
B.将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化BaCO3,是Qc(BaCO3)>Ksp(BaCO3)生成沉淀,所以可将BaSO4转化为BaCO3,故B正确;
C.△G=△H-T△S>0时该反应不能自发进行,该反应中△S>0,则△H>0,故C错误;
D.中和反应热的测定应使盐酸充分反应,需加入稍过量的NaOH溶液减少盐酸的挥发,减少误差,故D错误;
故选B.
点评:本题考查较综合,涉及反应的自发性与焓变的关系、中和反应测定、影响水电离的因素等知识点,注意B中沉淀转化的原因、D中酸碱的物质的量关系,这些都是易错点.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
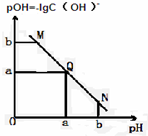 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH与pH的变化关系如图所示,则正确的是( )
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH与pH的变化关系如图所示,则正确的是( )| A、M点所示溶液导电能力强于Q点 |
| B、N点所示溶液中c(Na+)>c(CH3COO-) |
| C、M点和N点所示溶液中水的电离程度相同 |
| D、Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
下列图示与对应的叙述不相符的是( )
A、 如图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
B、 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
C、 如图表示0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1醋酸溶液得到的滴定曲线 |
D、 如图表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强 |
 某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )| A、催化剂能降低该反应的活化能 |
| B、逆反应的活化能大于正反应的活化能 |
| C、该反应为放热反应 |
| D、催化剂能改变该反应的焓变 |
生活中应注重食谱营养搭配的均衡性,下列午餐食谱中最有利于学生身体发育的是( )
| A、馒头、榨菜、黄瓜、香蕉 |
| B、面条、醋溜土豆丝、素炒白菜 |
| C、米饭、糖醋排骨、粉蒸肉、清蒸鲈鱼 |
| D、米饭、红烧鲫鱼、西红柿蛋汤、蒜蓉生菜、苹果 |
下列离子与氖原子具有不相同核外电子数的有( )
| A、Na+ |
| B、F- |
| C、Al3+ |
| D、S2- |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温下,32g SO2含有NA个氧原子 |
| B、0.1mol?L-1的氨水含有0.1NA个OH- |
| C、常温常压下,22.4L CCl4含有个NA个CCl4分子 |
| D、1mol铁与足量氯气反应,转移2NA个电子 |