题目内容
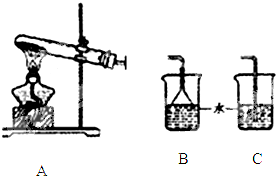
某兴趣小组利用如图仪器组装成一套装置,测量电解饱和食盐水后所得混合液的pH和验证氯气的氧化性.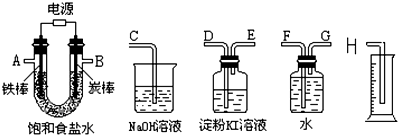
(1)实验时各种仪器接口的连接顺序(填编号)是:A接 ,B接 ;
(2)图中的“炭棒”能否换为“铁棒” (填“能”或“否”),理由是 ;(用电极反应式及相应文字说明)
(3)能证明氯气具有氧化性的实验现象是 ;
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6mL(标准状况)时停止通电,摇匀U形管内的溶液恢复至室温后溶液的pH约为 .

(1)实验时各种仪器接口的连接顺序(填编号)是:A接
(2)图中的“炭棒”能否换为“铁棒”
(3)能证明氯气具有氧化性的实验现象是
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6mL(标准状况)时停止通电,摇匀U形管内的溶液恢复至室温后溶液的pH约为
考点:实验装置综合
专题:实验题
分析:电解饱和食盐水,铁棒只能做阴极,否则被氧化,阳极不能生成氯气,阴极生成氢气,可用排水法收集并测量体积,A应连接G,F接H,碳棒生成氯气,可用淀粉KI检验氯气,则B连接D,E连接C,结合电解方程式计算溶液的pH,以此解答该题.
解答:
解:(1)A为阴极,生成氢气,可用排水法收集并测量体积,A应连接G,F接H,碳棒生成氯气,可用淀粉KI检验氯气,则B连接D,E连接C,
故答案为:G;D;
(2)电解饱和食盐水,铁棒只能做阴极,否则被氧化,阳极不能生成氯气,A极发生反应为2Cl--2e-=Cl2↑,
故答案为:否;该电极发生的反应是2Cl--2e-=Cl2↑,若换为铁棒,是铁失去电子被氧化,不能达到实验目的;
(3)如生成氯气,因氯气的氧化性比碘强,氯气可与KI反应生成碘,可观察到淀粉碘化钾溶液变蓝,
故答案为:淀粉碘化钾溶液变蓝色;
(4)因电解饱和食盐水的方程式:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,电解时2NaOH~H2↑,n(H2)=
=0.00025mol,c(NaOH)=
=0.01mol,则c(H+)=10-12mol/L,所以pH=12,
故答案为:12.
故答案为:G;D;
(2)电解饱和食盐水,铁棒只能做阴极,否则被氧化,阳极不能生成氯气,A极发生反应为2Cl--2e-=Cl2↑,
故答案为:否;该电极发生的反应是2Cl--2e-=Cl2↑,若换为铁棒,是铁失去电子被氧化,不能达到实验目的;
(3)如生成氯气,因氯气的氧化性比碘强,氯气可与KI反应生成碘,可观察到淀粉碘化钾溶液变蓝,
故答案为:淀粉碘化钾溶液变蓝色;
(4)因电解饱和食盐水的方程式:2NaCl+2H2O
| ||
| 0.0056L |
| 22.4L/mol |
| 0.00025mol×2 |
| 0.05L |
故答案为:12.
点评:本题考查较综合,为高频考点,涉及电解以及氯气的制备,题目较为综合,明确物质的种类为解答该题的关键,注意把握化学实验的原理和实验目的,题目难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
下列说法正确的是( )
| A、O2的摩尔质量为32g |
| B、22.4LCO和H2的混合气体所含分子数为NA |
| C、0.1molN2和O2的混合气体在标准状况下的体积为2.24L |
| D、若1 molCO2所占体积为22.4L,则其所处状况一定为标准状况 |
 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物.下列有关判断正确的是( )| A、简单氢化物的热稳定性:C>A |
| B、最高价氧化物对应水化物的酸性:D<C |
| C、B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 |
| D、A、C、D的最高价含氧酸的钠盐水溶液可能均显碱性 |
 某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2