题目内容
8.氨是重要的化工产品和化工原料.(1)氨的电子式是
 .
.(2)已知:如图3所示.
①合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol.
②降低温度,该反应的化学平衡常数K增大(填“增大”、“减小’’或“不变”).
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示.电池正极的电极反应式是N2+8H++6e-=2NH4+,A是NH4Cl.

(4)用氨合成尿素的反应为2NH3(g)+CO2(g)═CO(NH2)2(l)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线I、II、III对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为40%,则x13.
分析 (1)氨的分子中氮与氢原子之间形成一对共用电子对,总共存在3个氮氢键;
(2)①根据反应的△H=反应物的总键能-生成物的总键能计算出合成氨的焓变,然后写出热化学方程式;
②该反应放热,降温后平衡正向移动,生成物浓度增大,反应物浓度减小,化学平衡常数增大;
(3)该电池的本质反应是合成氨反应,所以正极是氮气发生还原反应,据此写出正极的电极反应式;生成的铵根离子与溶液中的氯化氢结合生成氯化铵;
(4)①根据图2可知,氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的;
②B点二氧化碳的转化率为60%,氨气的转化率是40%,设出NH3、CO2的起始物质的量,然后列式计算.
解答 解:(1)氨的分子中氮与氢原子之间形成一对共用电子对,所以氨的电子式是 ,故答案为:
,故答案为: ;
;
(2)①反应的△H=反应物的总键能-生成物的总键能,则合成氨的焓变为:△H=946kJ/mol+3×436kJ/mol-3×391×2kJ/mol=-92kJ/mol,所以合成氨的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol;
②该反应放热,所以降温,平衡正向移动,生成物浓度增大,反应物浓度减小,化学平衡常数将增大,
故答案为:增大;
(3)该电池的本质反应是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2+8H++6e-=2NH4+;
生成的铵根离子与溶液中的氯化氢结合生成氯化铵,所以A是NH4Cl,
故答案为:N2+8H++6e-=2NH4+;NH4Cl;
(4)①根据图2可知,氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的,则曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ曲线,
故答案为:Ⅲ;
②B点二氧化碳的转化率为60%,氨气的转化率是40%,
设NH3、CO2的起始物质的量分别为x、y,
则:x×40%×$\frac{1}{2}$=y×60%,
解得:$\frac{x}{y}$=x1=3,
故答案为:3.
点评 本题考查了化学平衡的计算、热化学方程式的书写、化学平衡常数及其应用等知识,为高考常见题型,题目难度中等,注意掌握化学平衡的影响因素、热化学方程式的书写原则,明确平衡常数的概念及表达式,试题有利于培养学生的分析、理解能力及化学计算能力.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案| A. | 高分子分离膜应用于食品工业中,可用于浓缩天然果汁、乳制品加工、酿酒业等 | |
| B. | 合成高分子材料制成的人工器官一般都受到人体的排斥作用,难以达到生物相容的程度 | |
| C. | 复合材料一般是以一种材料作为基体,另一种材料作为增强剂 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |
| A. | Cu2S的摩尔质量为160 | |
| B. | 每生产1molCu需转移2mol电子 | |
| C. | 该反应中Cu2S既是氧化剂又是还原剂 | |
| D. | 若用该反应生产铜,全世界每年产生的SO2的体积为1.4×106L |
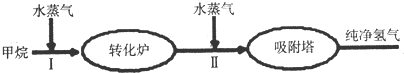
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$;反应的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(2)此流程的第Ⅱ步反应CO(g)+H2O(g)?H2(g)+CO2(g),在830℃,以表格的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有B(填实验编号)
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |

A.t2时加入了催化剂 B.t3时降低了温度 C.t3时增大了压强.
| A. | 物质的量是一个新的物理量,它表示的是物质的质量 | |
| B. | 周一上午升旗仪式时,学生和老师的物质的量共有2mol | |
| C. | 物质的量的单位是摩尔,简称摩,用mol表示 | |
| D. | 水的摩尔质量是18g |
| A. | K、L、M、N | B. | s、p、d、f | C. | px、py、pz | D. | ↑、↓ |
| A. | v(D)=24mol•L-1•min-1 | B. | v(C)=0.5mol•L-1•s-1 | ||
| C. | v(B)=30mol•L-1•min-1 | D. | v(A)=0.15 mol•L-1•s-1 |