题目内容
13.下列关于新型有机高分子材料的说法中不正确的是( )| A. | 高分子分离膜应用于食品工业中,可用于浓缩天然果汁、乳制品加工、酿酒业等 | |
| B. | 合成高分子材料制成的人工器官一般都受到人体的排斥作用,难以达到生物相容的程度 | |
| C. | 复合材料一般是以一种材料作为基体,另一种材料作为增强剂 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |
分析 A.高分子分离膜是由聚合物或高分子复合材料制得的具有分离流体混合物功能的薄膜;
B.医用高分子材料归属于功能高分子材料;
C.复合材料是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料;
D.导电塑料是将树脂和导电物质混合,用塑料的加工方式进行加工的功能型高分子材料.
解答 解:A.高分子分离膜应用于食品工业中,可用于浓缩天然果汁、乳制品加工、酿造业等,故A正确;
B.医用高分子材料归属于功能高分子材料,它们都无毒、具有良好的生物相容性和稳定性,有足够的机械强度等特点,故B错误;
C.复合材料是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料,一般是以一种材料作为基体,另一种材料作为增强剂,故C正确;
D.导电塑料是将树脂和导电物质混合,用塑料的加工方式进行加工的功能型高分子材料.主要应用于电子、集成电路包装、电磁波屏蔽等领域,故D正确;
故选B.
点评 本题考查了高分子化合物的结构与性质、合成材料的应用,题目难度不大,明确常见材料的组成、分类及及用途为解答关键,试题培养了学生灵活应用基础知识解决实际问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列实验操作中正确的是( )
| A. | 碘单质受热易升华,用加热法可以分离高锰酸钾和碘单质的混合物 | |
| B. | 分液时,分液漏斗内的上下层液体应分别都从下口放出 | |
| C. | 向溴水中加入苯,充分振荡后静置,上层无色,下层橙红色 | |
| D. | 配制100 g10%的CuSO4溶液,称取10 g硫酸铜固体溶于90 g水中 |
8.有关物质的分类中,说法错误的是( )
| A. | KNO3属于硝酸盐 | B. | CaO属于氧化物 | C. | NaHCO3属于酸 | D. | NaOH属于碱 |
5.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)?Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )
| A. | X的分解速率是Y的消耗速率的2倍 | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内生成l mol Y的同时分解2 mol X | |
| D. | 混合气体的密度不再变化 |
2. 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
若平衡表达式为K=$\frac{c(H_{2})•c(CO)}{c(H_{2}O)}$,则它所对应的化学反应方程式是(填序号)③.
(2)对反应①下列说法中能说明该反应达到平衡状态的bcd
a.温度和体积一定时,混合气体的颜色不再变化
b.温度和体积一定时,容器内的压强不再变化
c.温度和体积一定时,生成物的浓度不再变化
d.温度和体积一定时,混合气体的密度不再变化
(3)不同温度下反应②的平衡常数如下表所示.则△H2<0(填“<”或“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol•L-1、c(H2)=0.015mol•L-1,则CO的平衡转化率为75%.
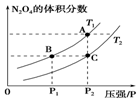
(4)对反应2NO2(g)?N2O4(g)△H<0在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.
则T1<T2(填“>”或“<”);增大压强,平衡正反应方向移动(填“正反应方向”或“逆反应方
向”或“不”); B、C两点的平衡常数B>C(填“>”或“<”).
 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
若平衡表达式为K=$\frac{c(H_{2})•c(CO)}{c(H_{2}O)}$,则它所对应的化学反应方程式是(填序号)③.
(2)对反应①下列说法中能说明该反应达到平衡状态的bcd
a.温度和体积一定时,混合气体的颜色不再变化
b.温度和体积一定时,容器内的压强不再变化
c.温度和体积一定时,生成物的浓度不再变化
d.温度和体积一定时,混合气体的密度不再变化
(3)不同温度下反应②的平衡常数如下表所示.则△H2<0(填“<”或“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol•L-1、c(H2)=0.015mol•L-1,则CO的平衡转化率为75%.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.945795506 | 9 | 1 |
则T1<T2(填“>”或“<”);增大压强,平衡正反应方向移动(填“正反应方向”或“逆反应方
向”或“不”); B、C两点的平衡常数B>C(填“>”或“<”).
 .
. .
.