题目内容
6.现有几种物质①NH4Cl ②Na2S ③Na2O2④H2S ⑤CO2 ⑥MgCl2回答问题:(1)①~⑥中,仅含离子键的是②⑥,仅含共价键的是④⑤,既有离子键又有共价键的是①③,(以上用数字代码回答)
(2)写出①NH4Cl③Na2O2⑤CO2三种物质的电子式①
 ③
③ ⑤
⑤ .
.
分析 (1)活泼金属和活泼非金属元素之间易形成离子键,铵根离子和酸根离子之间存在离子键;非金属元素之间易形成共价键;
(2)氯化铵中铵根离子和氯离子之间存在离子键、N-H原子之间存在共价键,过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,二氧化碳分子中C-O原子之间只存在共价键.
解答 解:(1)活泼金属和活泼非金属元素之间易形成离子键,铵根离子和酸根离子之间存在离子键;非金属元素之间易形成共价键,所以仅含有离子键的有②⑥,仅含有共价键的有④⑤,含有离子键和共价键的有①③,
故答案为:②⑥;④⑤;①③;
(2)氯化铵中铵根离子和氯离子之间存在离子键、N-H原子之间存在共价键,过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,二氧化碳分子中C-O原子之间只存在共价键,所以其电子式分别为 、
、 、
、 ,故答案为:
,故答案为: ;
; ;
; .
.
点评 本题考查化学键判断及电子式的书写,为高频考点,明确离子键和共价键概念及区别、电子式书写规则是解本题关键,注意氯化铵中存在的化学键,不能根据是否含有金属元素判断离子键,为易错点.

练习册系列答案
相关题目
14.生活中常会碰到某些化学问题,如:
①“白雪牌”漂粉精可令所有有色物质黯然失“色”,没有最白,只有更白
②霸王洗发液不含任何化学物质
③夏天混用不同品牌的墨水书写时,钢笔的笔尖容易发生堵塞是因为胶体发生了聚沉的原因
④53度白酒是指该白酒的着火点是53℃
⑤太太口服液含丰富的氮、磷、锌等微量元素.
则有关上述说法,你的看法是( )
①“白雪牌”漂粉精可令所有有色物质黯然失“色”,没有最白,只有更白
②霸王洗发液不含任何化学物质
③夏天混用不同品牌的墨水书写时,钢笔的笔尖容易发生堵塞是因为胶体发生了聚沉的原因
④53度白酒是指该白酒的着火点是53℃
⑤太太口服液含丰富的氮、磷、锌等微量元素.
则有关上述说法,你的看法是( )
| A. | 全部正确 | B. | 只有①⑤正确 | ||
| C. | 只有③正确 | D. | 以上说法都是错误的 |
12.用石墨作电极,电解1mol•L-1下列物质的溶液,溶液的pH变大的是( )
| A. | CuSO4 | B. | KCl | C. | H2SO4 | D. | Na2SO4 |
1.下列关于元素周期表和元素周期律的说法正确的是( )
| A. | ⅥA族元素的原子半径越大,越容易得到电子 | |
| B. | I A族与VIIA族元素间能形成离子化合物也能形成共价化合物 | |
| C. | I A族元素的金属性比ⅡA族元素的金属性强 | |
| D. | 原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族 |
11.pH值相等的盐酸(甲)和醋酸(乙),分别与一定量的锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是( )
| A. | 反应开始时的速率:甲<乙 | |
| B. | 反应开始时,酸的物质的量浓度:甲>乙 | |
| C. | 反应开始时,酸的物质的量浓度:甲<乙 | |
| D. | 反应所需时间:甲<乙 |
18.某气态烃0.5mol能与1mol HCl氯化氢完全加成,加成产物分子上的氢原子又可被3mol Cl2取代,则气态烃可能是( )
| A. | CH≡CH | B. | CH2=CH2 | C. | CH2=C(CH3)CH3 | D. | CH≡C-CH3 |
16. 请根据如表相关信息,回答问题.
请根据如表相关信息,回答问题.
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:Mg>Al>Na(用相应的元素符号表示).A、D两种元素中,电负性A>D (填“>”或“<”)
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl-取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×10{\;}^{30}M}{8ρr{\;}^{3}}$(用M、r、ρ表示).
 请根据如表相关信息,回答问题.
请根据如表相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl-取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×10{\;}^{30}M}{8ρr{\;}^{3}}$(用M、r、ρ表示).
 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.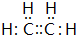 B的结构简式
B的结构简式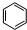 .
. ,反应类型:取代反应.
,反应类型:取代反应.