题目内容
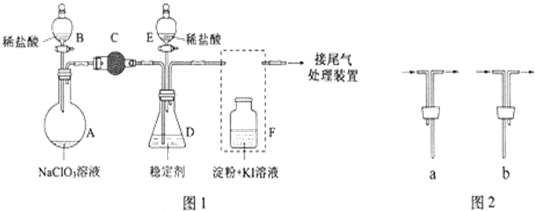
6.亚氯酸钠(NaClO2)是重要的漂白剂.某小组开展如下实验,按如图装置制取无水NaClO2晶体,回答下列问题:已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.

(1)装置C的作用是防止D瓶溶液倒吸到B瓶中;
(2)已知装置B中的产物有ClO2气体,则B中反应的方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置D中反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 ;
(3)从装置D反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃热水洗涤;④在在低于60℃条件条件下干燥得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl;
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:
ClO2-+4I-+4H+═2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).请计算所称取的样品中NaClO2的物质的量为c•V•10-3mol.
分析 装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,装置AE是利用氢氧化钠吸收多余的气体防止污染空气环境,
(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写方程式;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;
(5)根据化学反应可得关系式:NaClO2~2I2~4S2O32-,令样品中NaClO2的物质的量x,根据关系式计算.
解答 解:(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,
故答案为:防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,反应的方程式为:2NaClO3+Na2SO3+H2SO4=2 ClO2↑+2Na2SO4+H2O;
装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤; 洗涤; 在低于60℃条件;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl,
故答案为:NaClO3;NaCl;
(5)令样品中NaClO2的物质的量x,
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x c mol•L-1×V×10-3L
则:x=c•V•10-3mol
故答案为:c•V•10-3mol.
点评 本题考查制备方案的设计与评价,题目难度中等,涉及亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解实验原理是解题的关键,试题侧重考查学生的分析理解能力及灵活应用能力.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| A. | 铁粉跟稀硫酸反应Fe+2H+=Fe2++H2↑ | |
| B. | 氧化铝和稀硫酸反应 O2-+2H+=H2O | |
| C. | 氢氧化钡溶液跟稀硫酸反应 Ba2++SO42-=BaSO4↓ | |
| D. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ |
| A. | 四氯化碳-非电解质 氯化银-强电解质 碳酸-弱电解质 | |
| B. | NO2-酸性氧化物 CuO-碱性氧化物 Al2O3-两性氧化物 | |
| C. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| D. | 碘酒、淀粉溶液、水雾、纳米材料均为胶体 |
| A. | 氧化还原反应一定属于四大基本反应类型 | |
| B. | 氧化还原反应中,反应物不是氧化剂就是还原剂 | |
| C. | 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质 | |
| D. | 失电子越多,还原性越强,得电子越多,氧化性越强 |
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.9kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-241.8kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=+285.9kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+241.8kJ/mol |
(1)称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
(2)将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
(3)取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外)碱式滴定管,用酚酞作指示剂时,滴定到溶液颜色由红色刚好变成无色为止;
(4)某同学根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.