题目内容
7.某混合溶液含CaCl2和Mg(HCO3)2,其浓度分别为2a mol•L-1和a mol•L-1,要求只用一种试剂将Mg2+、Ca2+除掉,应选用的试剂是( )| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | Ca(OH)2 |
分析 除去溶液中的Mg2+和Ca2+,可分别生成Mg(OH)2和CaCO3沉淀,可加入NaOH,据此解题.
解答 解:A.加入氢氧化钠,可生成氢氧化镁和碳酸钙沉淀,可用于除杂,故A正确;
B.加入FeCl3,不能除掉氯化钙和镁离子,故B错误;
C.加入Na2CO3,与氯化钙反应生成碳酸钙沉淀,与Mg(HCO3)2不反应,不能除去杂质,故C错误;
D.加入Ca(OH)2,最终生成氯化钙,不能完全除去沉淀,故D错误.
故选A.
点评 本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.

练习册系列答案
相关题目
17.以葡萄糖为燃料的微生物燃料电池结构示意图如图,关于该电池的叙述不正确的是( )
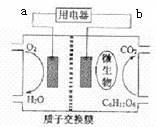

| A. | 微生物促进了反应中电子的转移 | |
| B. | 连接a的电极为负极 | |
| C. | 放电过程中,质子(H+)从负极区向正极区迁移 | |
| D. | 电池的负极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ |
15.某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知该反应为放热反应,氧化性K2Cr2O7>Cl2,则下列说法不正确的是( )
| A. | 由此反应可知:还原性HCl>CrCl3 | |
| B. | 每产生3mol Cl2,实际投入的盐酸要大于14mol | |
| C. | 氧化剂和还原剂的物质的量之比为1:6 | |
| D. | 当转移0.3mol电子时,被氧化的还原剂的物质的量为0.7mol |
12.如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积( )


| A. | 是a mL | B. | 是(50-a)mL | C. | 一定大于a mL | D. | 一定大于(50-a)mL |
19.下列气体不会造成大气污染的是( )
| A. | SO2 | B. | CO | C. | N2 | D. | NO |