题目内容
17.亚硝酸(HNO2)在反应中既可作氧化剂,又可作还原剂.当它作氧化剂时,其还原产物可能是( )①NO ②NO2 ③HNO3 ④N2 ⑤NH3.
| A. | ①③ | B. | ①②④ | C. | ①④⑤ | D. | 全部 |
分析 当它作氧化剂时,HNO2中N元素的化合价降低,判断选项中N元素的化合价小于+3即可,以此来解答.
解答 解:作氧化剂时,HNO2中N元素的化合价降低,则N元素的化合价小于+3即可,
①NO中,N元素的化合价为+2,为可能得到的还原产物;
②NO2中,N元素的化合价为+4价,为可能得到的氧化产物;
③HNO3中,N元素的化合价为+5价,为可能得到的氧化产物;
④N2中,N元素的化合价为0,为可能得到的还原产物;
⑤NH3中,N元素的化合价为-3,为可能得到的还原产物;
所以原产物可能是①④⑤;
故选C.
点评 本题考查氧化还原反应,侧重氧化剂的还原反应的考查,明确反应中作氧化剂中N元素的化合价降低即可解答,题目难度不大.

练习册系列答案
相关题目
7.某混合溶液含CaCl2和Mg(HCO3)2,其浓度分别为2a mol•L-1和a mol•L-1,要求只用一种试剂将Mg2+、Ca2+除掉,应选用的试剂是( )
| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | Ca(OH)2 |
8.如表陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 铝比铁活泼 | 通常情况下,铝比铁更容易被腐蚀 |
| B | Fe3+具有氧化性 | 铁盐溶液能净水 |
| C | 与水反应时,钠浮在水面上 | 钠与水反应是放热反应 |
| D | Al2O3的熔点高于Al的熔点 | 铝箔被加热到熔化时,也不滴落下来 |
| A. | A | B. | B | C. | C | D. | D |
9.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)═2Z(g)△H<0.当改变某个条件并达到新平衡后,下列叙述正确的是( )
| A. | 升高温度,X的物质的量减小 | |
| B. | 增大压强(缩小容器体积),Z的浓度不变 | |
| C. | 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变 | |
| D. | 保持容器体积不变,充入一定量的Z,重新平衡时,Y的体积分数增大 |
6.下列反应的离子方程式不正确的是( )
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| B. | FeCl3溶液中加入少量Na2S溶液:2Fe3++S2-═2Fe2++S↓ | |
| C. | 将适量CO2通入NaClO溶液中(已知次氯酸的K1为2.95×10-8)ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
7.下列有关化学用语表示正确的是( )
| A. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | 氟原子的结构示意图: | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 | |
| D. | 碳酸钠的电离方程式:Na2CO3═Na2++CO32- |
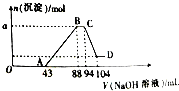 现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.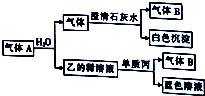 将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在如图转化关系,试回答下列问题:
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在如图转化关系,试回答下列问题: