题目内容
12.如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积( )
| A. | 是a mL | B. | 是(50-a)mL | C. | 一定大于a mL | D. | 一定大于(50-a)mL |
分析 根据滴定管刻度值从上到下刻度逐渐增大以及测量原理,注意滴定管最大刻度下方无刻度.
解答 解:滴定管刻度值从上到下刻度逐渐增大,由于滴定管最大刻度下方无刻度,50mL滴定管中实际盛放液体的体积大于50ml,如果液面处的读数是a,则滴定管中液体的体积大于(50-a)ml.
故选D.
点评 本题考查了计量仪器的构造及其使用方法,题目难度不大,注意量筒刻度值从下到上逐渐增大,而滴定管刻度值从上到下刻度逐渐增大,且最大刻度下方无刻度.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.温度为T时,向4L恒容密闭容器中充入2molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g),经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.0064mol/(L•s) | |
| B. | 保持其它条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入4molPCl3、4molCl2,达到平衡时,则此反应的化学平衡常数为0.025mol/L | |
| D. | 相同温度下,起始时间向容器中充入2molPCl5、0.40molPCl3和0.40molCl2,达到平衡前v(正)<v(逆) |
3.一定温度下已达化学平衡的反应:2X(g)+Y(g)═2Z(g),通过扩大容器体积来减小压强时,下列说法正确的是( )
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
7.某混合溶液含CaCl2和Mg(HCO3)2,其浓度分别为2a mol•L-1和a mol•L-1,要求只用一种试剂将Mg2+、Ca2+除掉,应选用的试剂是( )
| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | Ca(OH)2 |
17.我国海洋资源丰富,开发利用具有广阔前景.
(1)利用海水可制备氯气.
①制得的氯气,为便于储存,要将其液化[C12(g)?Cl2(l)],应采取的措施是降温(或加压)(只写出一种措施).
②液氯储存区贴有的说明卡如表(部分):
用离子方程式表示“泄漏处理”中NaHSO3溶液的作用.HSO3-+C12+H2O=SO42-+2C1-+3H+
若氯气泄漏后遇到苯,在钢瓶表面氯气和苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯气与苯的反应有催化作用
(2)利用海水脱硫可解决燃煤排放SO2造成的环境问题,工艺流程如图:
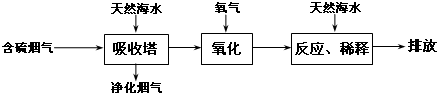
①天然海水呈碱性,写出SO2与过量海水中OH-的反应的离子方程式.SO2+2OH-=SO32-+H2O
②天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,请写出氧化过程中H2SO3被氧化的化学方程式:2H2SO3+O2=2H2SO4;氧化后的“海水”需要引入大量的天然海水与之混合才能排放,该操作的主要目的是中和经氧气氧化后海水中生成的酸【或中和酸;降低氧化后溶液的酸性】
(3)工业从海水中提溴的过程如下:
海水$\stackrel{除去悬浮杂质}{→}$$\stackrel{浓缩}{→}$$→_{氧化}^{氧化剂}$$\stackrel{热空气}{→}$Br2(g)$→_{吸收}^{Na_{2}CO_{3}溶液}$$[\begin{array}{l}{NaBr}\\{NaBr{O}_{3}}\end{array}]$$\stackrel{H_{2}SO_{4}}{→}$Br2
①通过热空气的目的是将Br2吹出
②溶液中的NaBr、NaBrO3用足量的硫酸处理后得到Br2单质,每生成1mol Br2转移电子的物质的量是1.67mol.
(1)利用海水可制备氯气.
①制得的氯气,为便于储存,要将其液化[C12(g)?Cl2(l)],应采取的措施是降温(或加压)(只写出一种措施).
②液氯储存区贴有的说明卡如表(部分):
| 危险性 | 危险品 |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质,设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
若氯气泄漏后遇到苯,在钢瓶表面氯气和苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯气与苯的反应有催化作用
(2)利用海水脱硫可解决燃煤排放SO2造成的环境问题,工艺流程如图:

①天然海水呈碱性,写出SO2与过量海水中OH-的反应的离子方程式.SO2+2OH-=SO32-+H2O
②天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,请写出氧化过程中H2SO3被氧化的化学方程式:2H2SO3+O2=2H2SO4;氧化后的“海水”需要引入大量的天然海水与之混合才能排放,该操作的主要目的是中和经氧气氧化后海水中生成的酸【或中和酸;降低氧化后溶液的酸性】
(3)工业从海水中提溴的过程如下:
海水$\stackrel{除去悬浮杂质}{→}$$\stackrel{浓缩}{→}$$→_{氧化}^{氧化剂}$$\stackrel{热空气}{→}$Br2(g)$→_{吸收}^{Na_{2}CO_{3}溶液}$$[\begin{array}{l}{NaBr}\\{NaBr{O}_{3}}\end{array}]$$\stackrel{H_{2}SO_{4}}{→}$Br2
①通过热空气的目的是将Br2吹出
②溶液中的NaBr、NaBrO3用足量的硫酸处理后得到Br2单质,每生成1mol Br2转移电子的物质的量是1.67mol.
4.关于合金的叙述,不正确的是( )
| A. | 合金的熔沸点比原任一金属要高 | B. | 合金的硬度比原任一金属要大 | ||
| C. | 非金属也可以是合金的成分之一 | D. | 合金的用途比纯金属的用途更广 |
1.实验室金属钠着火用什么方法来扑灭( )
| A. | 用泡沫灭火器 | B. | 用水扑灭 | ||
| C. | 用干燥的沙子盖灭 | D. | 用煤油 |
 ,其分子的空间构型为三角锥型.
,其分子的空间构型为三角锥型.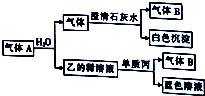 将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在如图转化关系,试回答下列问题:
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在如图转化关系,试回答下列问题: